SF4 分子構造の構造は、VSEPR 理論の原則を使用して予測できます。結合していない孤立電子対は、3 つの赤道位置の 1 つを占めます。その結果、分子には 2 種類の F 配位子があります:アキシャルとエクアトリアルです。
化学式 AX4E を持つ分子の SF4 分子構造と結合角は、三方両錐です。硫黄原子との結合を確立する 2 つのフッ素原子の赤道方向が示され、他の 2 つの軸方向の位置が示されています。コア原子には孤立電子対が 1 つあるため、結合対と反発し、形状が変化してシーソーのような外観になります。
SF4 分子構造の重要性
SF4 の分子構造と結合角の重要性を理解することは非常に重要です。
SF4 ハイブリダイゼーションとは?
原子価結合とハイブリダイゼーションは、一般的に一緒に教えられているにもかかわらず、原子価殻電子対反発 (VSEPR) 仮説とは関連していません。 SF4 には孤立電子対が 1 つと F シグマ結合が 4 つしかありません。 S はコア原子です。別の言い方をすれば、4 つのボンディング ゾーンがあり、それぞれに 1 つの孤立したペアがあります。
硫黄の 3s 軌道は完全に満たされていますが、4f の 3p 軌道は満たされていないため、結合を形成するには 4 つの半分満たされた軌道、または各軌道に 1 つの電子しかない軌道が必要です。その結果、3p 軌道からの電子が硫黄の励起状態で 3d 軌道に励起され、4 つの軌道がフッ素原子との結合に利用できるようになります。
これと同等の「超原子価」化合物には d 軌道が必要ないため、混成は SF4 を理解するための悪い方法です。このアイデアは、非整数結合を完全に理解する前に開発されました。
硫黄では、孤立電子対が 4 つある単結合を生成することによって結合が発生します。その結果、5 つの異なる電子密度ゾーンを特定できます。
S 原子の 5 つの価電子原子軌道は中央で混成され、5 つの sp3d 混成軌道を生成します。 2p 軌道では、4 つの混成軌道が重なっていますが、5 番目の軌道はペアが 1 つしかありません。立体数を使用して、原子が持つ混成軌道の数を決定できます。硫黄は 5 つの軌道を使用します:1 つの 3s 軌道、3 つの 3p 軌道、および 1 つの 3d 軌道です。
SF4 のルイス構造
ルイス構造は、SF4 分子の形状、結合角、および価電子を視覚的に表しています。線は 2 つの原子間で作成された結合を表し、点は結合を形成しない価電子を表します。結合電子対は結合の形成に関与しますが、孤立電子対としても知られる非結合電子対は結合に関与したり確立したりしません。
SF4 の原子価殻の電子の総量
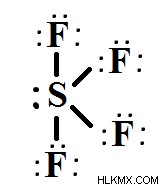
四フッ化硫黄は、硫黄とフッ素の 2 つの元素のみで構成されています。硫黄は、最終殻 (原子価殻) に 6 つの電子を持つ周期表グループ VIA 元素です。フッ素は、最終殻に 7 つの電子を持つ周期表の第 VIIA 族元素です。
SF4 では、S の電子対配置は何ですか?
SF4 の核となる元素である硫黄は、立体数 5 を持ち、各フッ素と孤立電子対への単一の結合を持っています。電子対は、孤立電子対が中央にある三方両錐体として編成されます。軸位置の 2 つの結合は 90 度の角度を形成しますが、赤道位置の結合は 120 度の角度を形成します。 SF4 分子の形状 (原子の配置によって定義される) は「シーソー」です。
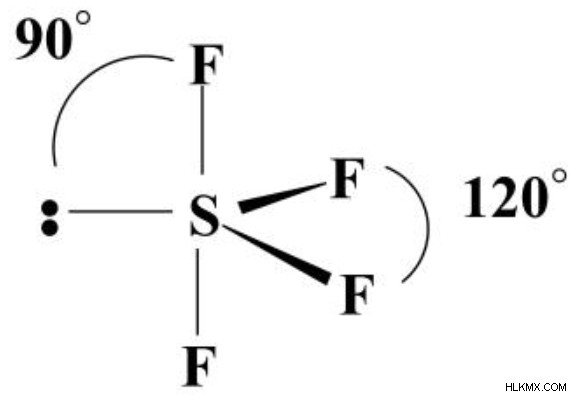
単結合がいずれかの軸方向にある場合、3 つの単結合は 90 度になります。電子が 90 度だけ離れている場合、反発の量は大幅に大きくなります。角度を分析して角度を伸ばすと、反発が大幅に減少します。
SF4 は極性ガスですか?
両方の元素の電気陰性度を分析することは、分子が極性か非極性かを識別する 1 つのアプローチです。絶対に手元に置いておくべき非常に便利な周期表を以下に含めました。
SF4 の電気陰性度 (EN =2.98) の差は 1.7 を超えており、極性分子であることを示しています。
分子が極性か非極性かを判断する別の方法は、化合物のルイス ドット構造を引き出すことです。四フッ化硫黄の中心原子は 2 つの余分な電子を獲得し、SF4 分子に 4 つの共有結合と 1 対の非結合電子を与えます。電気陰性度のバランスが崩れ、部分的なイオン電荷が形成されると、電子は均等に分布しません。電気陰性度の差が大きいほど、結合はよりイオン的になります。部分的なイオン結合は、極性共有結合と呼ばれます。これは、電子の不均一な共有を示すため、極性共有結合です。一方、非極性分子は電子を均等に共有します。その結果、SF4 は有極性です。
結論
コアの硫黄原子の周りに、SF4 には 5 つの電子密度ゾーン (4 つの結合と 1 つの孤立電子対) が含まれています。三角両錐は、シーソー構造を生成します。四フッ化硫黄には 34 個の価電子が含まれており、そのうち 4 個の共有結合と 1 個の孤立電子対がルイス構造のコア原子に形成されます。各フッ素原子には、3 つの孤立電子対があります。分子構造 AX4E を持ち、三方両錐の分子構造でシーソー形状を作成します。 SF4 は本質的に極性があり、sp3d ハイブリダイゼーションを特徴としています。







