主な違い - イオン性化合物と共有結合性化合物
化学のほぼすべての化合物は、イオン性化合物と共有結合性化合物に大きく分類できます。 それらは、分子/化合物の作成に関与する原子間の結合タイプにより、互いに異なります。その名前が示すように、 イオン性化合物はイオン結合でできており、共有結合性化合物は共有結合でできています。互いに静電的に引き寄せられる 2 つの種の間でイオン結合が発生し、 一方、共有原子は、外殻間で電子を共有することで共有結合します .これが主な違いです イオン性化合物と共有結合性化合物の間。一般に、金属元素はイオン化合物を形成する傾向があり、非金属元素は最後に共有結合を形成します。
イオン化合物とは
前述のように、イオン性化合物は、反対の電荷を持つために互いに引き寄せられる原子間の静電力の結果です。各要素は、外殻で安定した電子配置 (希ガスの電子配置) を達成しようとします。希ガスの電子配置を持つことで、原子はすでに安定しているため、原子がさらに反応するのを防ぎます。したがって、電子的に安定していない自然界の元素は、最も近い希ガス構成を実現するために、余分な電子を放出するか、不足している数の電子を受け入れる傾向があります。この原理によってイオンが形成されます。安定した電子配置を達成するために余分な電子を放出する傾向がある原子は、(負に帯電した電子の損失により) 正に帯電することになり、これらは「陽イオン」と呼ばれます。 」同様に、原子が電子を受け取って最終的な殻構造を完成させると、(負に帯電した電子の増加により) 原子は負に帯電し、これらは「陰イオン」と呼ばれます。 」したがって、定義上、陰イオンと陽イオンの間にイオン結合が形成されます .
一般に、イオン化合物を形成する原子は反対の電荷を帯びた原子に囲まれます。したがって、それらは単一の分子実体を形成するのではなく、「結晶」と呼ばれるクラスターにグループ化されます。したがって、イオン化合物は本質的に固体である傾向があり、イオン結合が非常に強いため、通常は非常に高い融点を持っています。実際、それは存在する最も強いタイプの化学結合です。液体の状態では、イオンが自由に移動できるため、優れた導電性材料になります。イオンは、本質的に原子または分子である可能性があります。つまり、CO3 分子陰イオンです。 H(水素)が陽イオンの場合は酸、陰イオンがOHの場合は塩基と呼ばれます。イオン性化合物の例としては、NaCl、MgCl2、 などがあります。 等 
共有結合化合物とは
これらは、共有結合した原子によって形成される化合物です。共有結合はイオン結合よりもはるかに弱いため、ほとんどの共有結合化合物は気相に存在します。前述のように、原子は安定した電子配置を実現するために化合物を形成する必要があります。そして、これを得る 3 つ目の方法 (イオン結合の場合に述べたように、電子を与えたり受け取ったりすることは別として) は、電子を共有することです。
この方法では、化合物の形成に関与する両方の原子が必要な数の電子を共有します (通常、1 つのドナー原子とアクセプター原子が同じ量を探します)。共通の重なり合った軌道空間で。電子の共有が行われる前に、軌道の重なりのために原子が互いに接近することが重要です。したがって、この場合、どちらの原子も帯電せず、中性のままです。重ね合わせは直線的にまたは平行に行うことができる。向きが直鎖状の場合は「σ結合」、そうでない場合は「π結合」と呼ばれます。さらに、この電子の共有は、類似したタイプの原子間だけでなく、異なるタイプの原子間でも発生する可能性があります。関与する原子が類似している場合、得られる化合物は「二原子分子」と呼ばれます。H2 O、CO2、 などが一般的な例です。 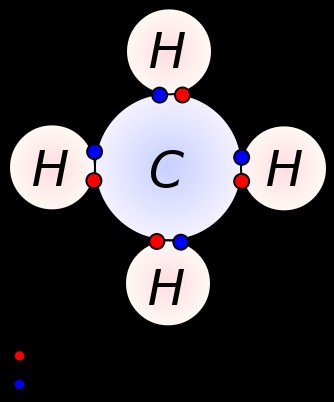
イオン性化合物と共有結合性化合物の違い
定義
イオン 化合物はイオン結合でできており、原子は静電的に互いに引き寄せられます。
共有 化合物は、形成に関与する原子間で電子が共有される共有結合でできています。
関係する種
イオン 化合物は、陽イオンと陰イオンの間の相互作用によって発生します。
共有 化合物は中性原子の相互作用によって発生します。
強さ
イオン 結合は化学結合の中で最も強力なタイプであるため、ほとんどの化合物は非常に高い融点で固体のままです。
対照的に、共有 結合は非常に弱いため、ほとんどの化合物は気相で存在します。
導電率
イオン 化合物は、液体の形で良好な導電媒体になります。
共有 化合物は良好な導電体ではありません.