溶解度は、化学の最も興味深い部分の 1 つです。カラフルな沈殿物が形成される、または再溶解するのを見るのは、非常にエキサイティングです。この記事では、一般的な溶解度ルールについて見ていきます どの陰イオンと陽イオンが通常可溶性で、どれがそうでないかを述べています。また、多くの一般的なイオン化合物の溶解度を示す溶解度チャートも表示します。
これらの溶解度規則は、2 つのイオン性化合物が溶液中で混合されたときに沈殿物が形成されるかどうかを予測するのに役立ちます。イオンのすべての組み合わせが可溶性である場合、沈殿物は形成されず、多くの場合、単一の化合物を分離することはできません.
溶解性ルール
<オール>溶解度とは?
溶解度とそれに関連するいくつかの用語について説明しましょう。
- 不溶性 – 1 リットルに溶ける量は 1 グラム未満
- 1 リットルに 1 ~ 10 グラムが溶ける微溶性
- 1リットルに10~30グラム溶ける難溶性
- 溶ける – 1 リットルに 30 グラム以上溶ける
- 沈殿物 – 形成された化合物が溶解しない場合に、溶液から出てくるもの
- コーヒー フィルター – 溶液から沈殿物を分離する優れた方法です!
- 飽和溶液 – 最大量の化合物が溶液に溶解した溶液
- 過飽和溶液 – 最大溶解量を超える溶液。これは通常、熱湯で飽和溶液を形成し、種結晶が生じないように溶液を非常にゆっくり冷却することによって行われます。 現在
- 溶媒 – 化合物を溶かす液体
- 上澄み – 沈殿物を除去またはろ過した後に残る溶液
この記事の溶解度の規則は、室温での水です。一部の化合物は、温水または冷水での溶解度が大きく異なる場合があります。たとえば、臭素酸カリウムは熱湯にはよく溶けますが、非常に冷たい水にはほとんど溶けません.
最も不溶性のイオン性化合物でさえ、非常にわずかな程度でイオンに溶解します。 Ksp 値として知られる溶解度積定数により、実際に溶解する量を計算できます。
一部の化合物は、溶解するのに時間がかかる場合があります。たとえば、硫酸銅 (II) 五水和物の結晶は溶解するのに永遠にかかるようであり、溶解を早めるためにマグネティック スターラーを頻繁に作動させる必要があります。
興味深い溶解度の事実と例外
- 塩素酸カリウム、臭素酸カリウム、および過塩素酸カリウムは、冷水にわずかしか溶けません。この事実は、溶液中のナトリウムからカリウムを分離するために使用できます。
- 酢酸ナトリウムは水に非常に溶けやすいため、過飽和溶液を形成するのが難しい場合があります
- ギ酸ルビジウム、ギ酸タリウム、過塩素酸銀は最も溶けやすい 3 つの化合物で、室温で 1 リットルの水にそれぞれ 5,000 グラム以上溶解します!
- 等量のギ酸タリウムとマロン酸タリウムの溶液は、どちらも非常に溶けやすく、Clerici 溶液として知られています。それはおそらく水溶液の中で最も高い密度を持っています。ミネラルを密度で分離することができます。
- 臭素酸とギ酸は一般に可溶性
- 銅 (I) ハロゲン化物は不溶ですが、この例外は通常、標準の溶解規則には記載されていません
- 鉛、水銀 (II)、および硫酸銀はわずかに溶けます
- 硫化物は、最も不溶性のイオンの 1 つです。たとえば、すべての鉛を溶液から除去する必要がある場合、できるだけ多くの鉛を沈殿させるために硫化ナトリウムがしばしば追加されます。最も不溶性のイオン性化合物の 1 つは、硫化水銀 (II) です。
- シュウ酸塩は、Na、K、NH4 を除いて非常に不溶性です。 ルビジウムやシュウ酸セシウムも不溶です。
溶解度チャート
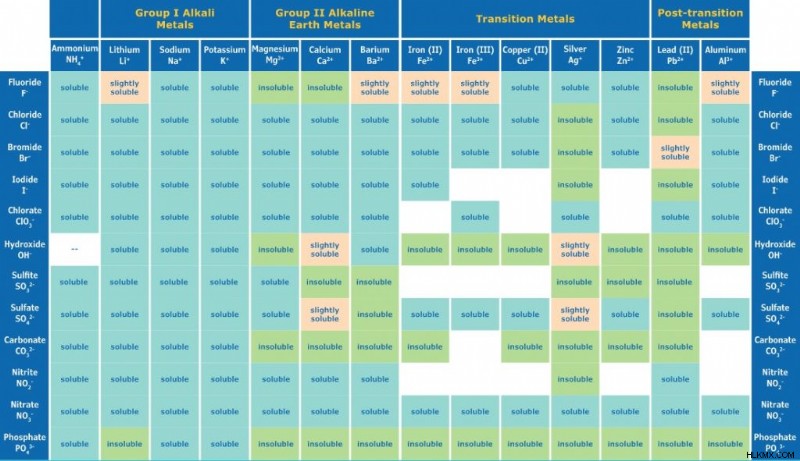
この溶解度チャートは、一般的なイオンの溶解度を示しています。空白は、化合物が水溶液中で安定していないことを意味します。チャートはシグマ提供。より完全なチャートについては、こちらをご覧ください。
溶解性ルール – 参考文献
平衡定数
化学反応の種類
陽イオンと陰イオン
Ksp – 溶解度積定数
ビデオ – 不溶性化合物が溶液から落ちるのを見る