主な違い – カーボン 12 とカーボン 14 の違い
一部の元素は、同位体として知られるさまざまな形で存在できます。元素の同位体には、同じ数の電子と陽子が含まれていますが、中性子の数は異なります。したがって、同じ元素であっても質量が異なります。元素の質量数は、その原子核の中の中性子と陽子の合計です。したがって、同位体は質量数で表されます。たとえば、炭素は 3 つの形態で存在する元素です。つまり、炭素には 3 つの同位体があります。炭素 12、炭素 13、炭素 14 です。炭素 12 の質量数は、中性子 6 個と陽子 6 個を含むため、12 です。同様に、炭素 13 同位体には中性子 7 個と陽子 6 個が含まれ、炭素 14 同位体には中性子 8 個と陽子 6 個が含まれます。同位体を持つほとんどの元素には、自然界に豊富に存在する主要な同位体が1つあり、残りの同位体は非常に小さな割合で存在します.したがって、元素の相対原子質量を考慮する場合、通常、相対質量数は主要な同位体または豊富に存在する同位体の質量数に等しいと想定されます。 炭素 12 同位体と炭素 14 同位体の主な違いはその安定性です; 炭素 12 同位体は炭素 14 よりも安定しています .
対象となる主な分野
1.カーボン 12 とは
– 定義、構造、プロパティ
2.カーボン 14 とは
– 定義、構造、プロパティ
3. Carbon 12 と Carbon 14 の違いは何ですか
– 主な違いの比較
重要な用語:同位体、炭素、炭素同位体、質量数、中性子、炭素 12、炭素 14、放射能、アボガドロ定数 
カーボン 12 とは
炭素 12 同位体は、自然界に存在するすべての炭素の約 98.89% を構成する最も豊富な炭素同位体です。それはすべての生物系に見られます。炭素 12 原子は、その原子核に 6 個の中性子と 6 個の陽子を含んでいます。炭素 12 同位体は安定しており、放射性ではありません。したがって、炭素14とは異なり、崩壊しません。炭素 12 原子は、他の原子の質量が炭素 12 同位体の原子の質量と比較される相対原子質量スケールを定義するために使用されます。ここでは、炭素 12 を標準原子とします。元素の相対原子質量 (RAM) は、周期表に示されています。 RAM と同じように、ほくろは炭素 12 同位体に基づいています。 12.00 g の炭素 12 に含まれる原子の数を基準として、モルを定義します。 12 g の炭素 12 に含まれる原子の正確な数は、6.02 x 10 であることがわかりました . 19 世紀にイタリアの化学者アメデオ アボガドロがこの数を発見しました。この数はアボガドロ定数として定義されています .アボガドロ定数の単位はモルです。
カーボン 14 とは
炭素 14 は炭素の不安定同位体で、8 個の中性子と 6 個の陽子を含んでいます。したがって、質量数は 14 です。炭素の他の同位体とは異なり、炭素 14 は放射性です。したがって、時間とともに減衰します。炭素 14 同位体は、自然界に存在するすべての炭素の約 0.01% 未満を占めています。炭素 14 の崩壊作用は自然発生的です。炭素 14 は崩壊して窒素 14 原子を形成します。生物は、光合成中または有機物を食べている間に炭素 14 を獲得します。生物が死ぬと、炭素14源の摂取をやめます。これにより、炭素14は崩壊し始め、炭素14の半減期と呼ばれる約5730年で元の量の半分になります。炭素 14 の残りの量を測定し、ほとんどの生きた標本に存在する量と比較することができます。そうすることで、科学者は炭素14を使って化石の年代を決めることができます。ただし、炭素 14 同位体の放射能は 5 万年を過ぎると非常に遅くなるため、炭素 14 は 5 万年より古い化石に適用されます。
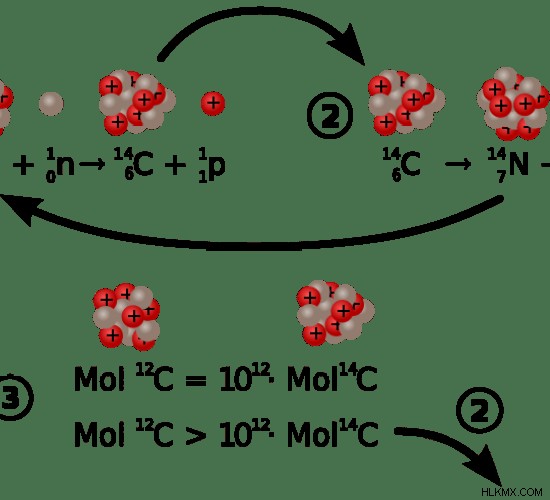
図 1:炭素 14 の形成と崩壊
Carbon 12 と Carbon 14 の違い
質量数
炭素-12: 炭素 12 の質量数は 12 です。
炭素-14: 炭素-14 の質量数は 14 です。
原子中の中性子の数
炭素-12: 炭素 12 には 6 個の中性子があります。
炭素-14: 炭素 14 には 8 個の中性子があります。
安定性
炭素-12: 炭素 12 は安定しています。
炭素-14: 炭素 14 は不安定です。
放射能
炭素-12: 炭素 12 は放射性ではありません。
炭素-14: 炭素 14 は放射性です。
申し込み
炭素-12: 炭素 12 は、すべての生物系の構成要素です。
炭素-14: 炭素 14 は、50,000 年前の化石の年代を測定するために使用されます。
同位体分布
炭素-12: 炭素 12 は、自然界に存在するすべての炭素の 99% に含まれています。
炭素-14: 炭素 124 は、天然に存在するすべての炭素の 0.01% 未満です。
結論
炭素 12 と炭素 14 は、2 種類の炭素同位体です。炭素 12 は、炭素の最も豊富な同位体であり、放射能がないため安定しています。ただし、炭素 14 は放射能のために安定ではありません。そのため、炭素 14 は生物系ではめったに発見されません。これが炭素 12 と炭素 14 の違いです。
参照:
1. ブライトハウプト、ジム。物理学 (Palgrave Foundations シリーズ)。 N.p.:Palgrave Macmillan;, 2010. Print.
2.Knorr, Susan.原子について学びます。ノースカロライナ州グリーンズボロ:マーク トウェイン メディア、2004 年。印刷。
画像提供:
1.「炭素 14 の形成と崩壊」 C14_methode_physikalische_grundlagen.svg 著:Sgbeerderivative work:NikNaks talk – gallery – wikipedia – C14_methode_physikalische_grundlagen.svg (CC BY-SA 3.0) via Commons Wikimedia







