主な違い – ベンゼンとフェニル
芳香族化合物は、環内に単結合と二重結合が交互に並んだ環構造を持つ化合物です。芳香族化合物のほとんどはベンゼン環で構成されています。フェニルはベンゼンの誘導体です。ベンゼンとフェニルの主な違いは、ベンゼンは 6 つの水素原子で構成されていることです。 一方、フェニルは 5 つの水素原子で構成されています。
対象となる主な分野
1.ベンゼンとは
– 定義、構造、プロパティ、アプリケーション
2.フェニルとは
– 定義、構造、プロパティ、アプリケーション
3.ベンゼンとフェニルの類似点
– 共通機能の概要
4.ベンゼンとフェニルの違いは何ですか
– 主な違いの比較
重要な用語:芳香族化合物、ベンゼン、求電子性、求核性、フェノール、フェニル

ベンゼンとは
ベンゼンは、石油に含まれる無色の揮発性の液体炭化水素です。リング構造です。 ベンゼンの化学式 C6 です H6 .すべての炭素原子は、交互に配置された 3 つの単結合と 3 つの二重結合によって互いに結合されています。 6 個の水素原子は、6 個の炭素原子に、各炭素につき 1 つずつ結合しています。二重結合が存在するため、π 結合の電子が結合され、ベンゼン環の上部と下部に 2 つの電子雲が形成されます。電子雲はベンゼン環の平面に平行です。このベンゼンの構造は、ケクレ (1872) によって最初に提案されたため、ケクレ構造 と呼ばれています。 .

図 1:ベンゼンの構造
ベンゼン環のすべての炭素原子は sp 混成です。一般に、C-C 単結合の結合長は C=C 二重結合よりも長いですが、ベンゼンのすべての結合は同じ長さです。電子雲の形成により、ベンゼンの結合長は、単結合と二重結合の間の長さになります。ベンゼンは平面構造であり、環上での置換が可能なため、他の多くの高度な化合物の合成に使用できます.
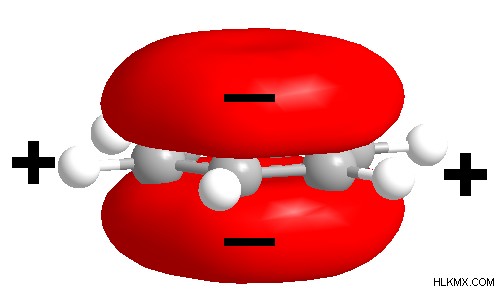
図 2:ベンゼンの 2 つの電子雲
ベンゼン環は電子が豊富です。したがって、ベンゼンは十分に求核性です。したがって、ベンゼンが受けることができる主な反応は求電子置換です。ベンゼンはその電子を求電子試薬と共有できます。求電子成分は、安定するために電子を欠いている分子です。
フェニルとは
フェニルはベンゼンから派生した基で、別の分子と結合することができます。 フェニル基の化学式 C6 です H5 .また、ベンゼン環と同様に二重結合が交互に並んでいます。フェニル基には、水素原子が欠落している空点があります。したがって、このグループは、この点を介して別の分子に結合できます。これにより、フェニル基が非常に反応しやすくなります。
フェニル基とベンジル基を同じものと考える人もいます.しかし、ベンジル基には-CH2があるため、それらは非常に異なります – ベンゼン環に結合した基。
フェニル基が見られる最も一般的な分子はフェノールです。そこでは、フェニル基が –OH 基と結合しています。
-

図 3:フェニル基 (青色)
- 図 3:フェニル基 (青色)
ベンゼンとフェニルの類似点
- 両方の分子は 6 つの炭素原子で構成されています。
- どちらもリング構造です。
- どちらも平面構造です。
- 炭素原子の混成は、ベンゼンとフェニルの両方をスピンします。
- 炭素原子間の結合長が等しい (1.4 A)
ベンゼンとフェニルの違い
定義
ベンゼン: ベンゼンは、石油に含まれる無色の揮発性の液体炭化水素です。
フェニル: フェニルはベンゼンから派生した基で、別の分子と結合することができます。
水素原子の数
ベンゼン: ベンゼンには 6 つの水素原子があります。
フェニル: フェニルには 5 つの炭素原子があります。
安定性
ベンゼン: ベンゼンは単独では安定です。
フェニル: フェニルは単独では安定ではありません。
化学式
ベンゼン: ベンゼンの化学式はC6 H6 .
フェニル: フェニルの化学式はC6 H5 .
結論
ベンゼンは、さまざまな重要な化合物の合成に広く使用されています。しかし、人間の消費に密接な関係がある製品のためにベンゼンを選択するときは注意が必要です.それは、ベンゼンに発がん作用があることが発見されたからです。フェニルはベンゼン由来の置換基です。ベンゼンとフェニルの主な違いは、ベンゼンが 6 つの水素原子で構成されているのに対し、フェニルは 5 つの水素原子で構成されていることです。







