主な違い - 電気化学セルと電解セル
電気化学には、化学プロセスが行われる系における電子の動きの研究が含まれます。ここで、化学反応を使用して電流を生成することができ、または電流を使用して非自発的化学反応の発生を促進することができる。どちらの方法でも、電気エネルギーから化学エネルギーへの変換、またはその逆が発生します。これらの変換が行われるシステムは、セル、またはより正確には電気化学セルとして知られています。ボルタ電池と電解セルとして知られる電気化学セルには、2 種類あります。電気化学セルと電解セルの主な違いは、電気化学セルは操作に外部電流を必要としないことです。 一方、電解セルの動作には外部電流が必要です。
対象となる主な分野
1.電気化学セルとは
– 定義、プロパティ、仕組み
2.電解セルとは
– 定義、プロパティ、仕組み
3.電気化学セルと電解セルの違いは何ですか
– 主な違いの比較
重要な用語:アノード、カソード、電気化学セル、電気分解、電解セル、ガルバニ電池、酸化、還元、ボルタ電池 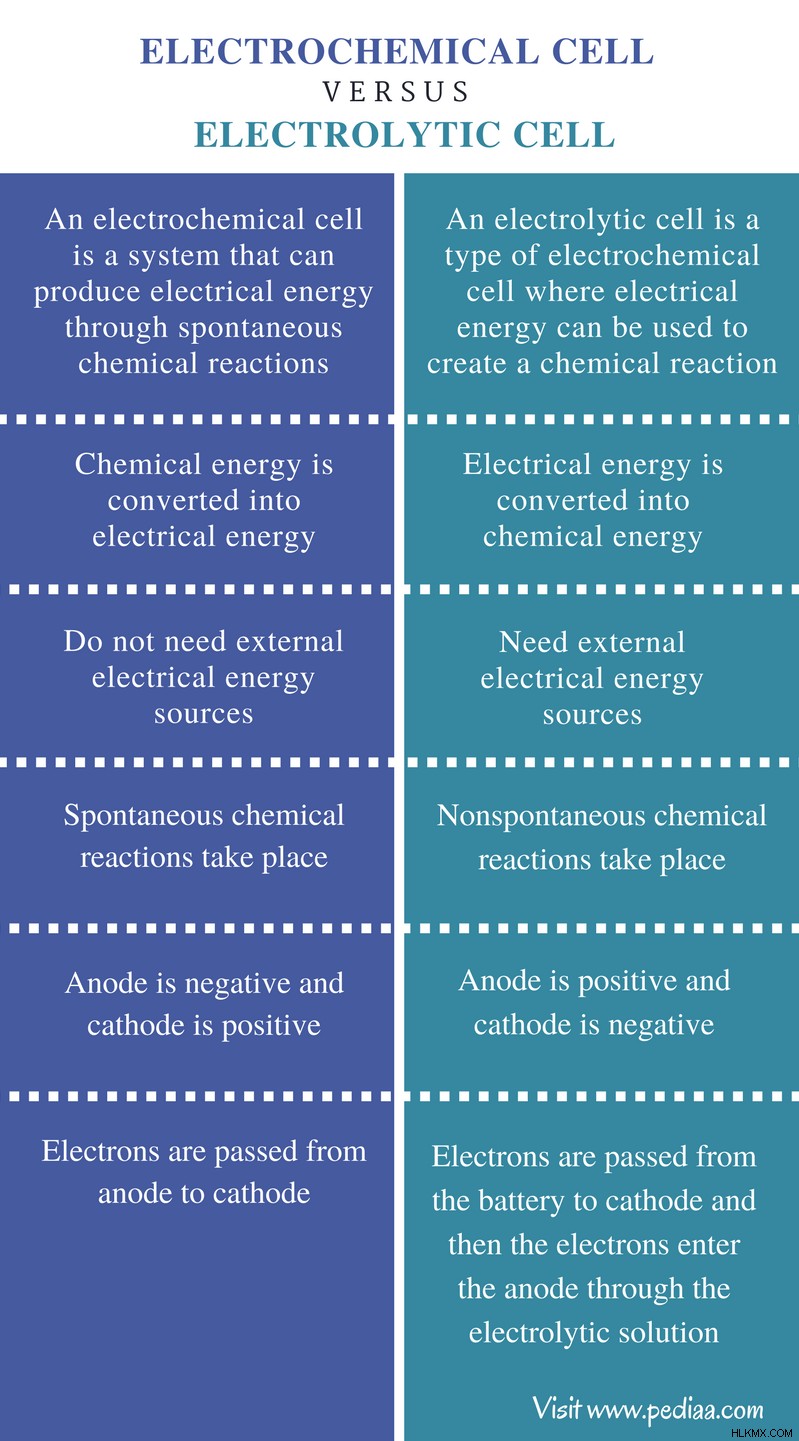
電気化学セルとは
電気化学セルは、自発的な化学反応によって電気エネルギーを生成できるシステムです。このプロセスに関与する化学反応は、酸化還元反応と呼ばれます。酸化還元反応は、化学種間の電子の移動によって発生します。酸化還元反応には、酸化反応と還元反応の 2 つの半反応があります。酸化反応は常にシステムに電子を放出しますが、還元反応はシステムから電子を奪います。したがって、2 つの半反応が同時に発生します。
電気化学セルには、ボルタ (ガルバニック) セルと電解セルの 2 種類があります。電気化学セルは、2 つの半セルで構成されます。半反応は、2 つの半セルで発生します。そのセルで起こる化学反応により、2 つの半セル間に電位差が生じます。
半電池は、電極と電解質で構成する必要があります。したがって、完全な電気化学セルは、2 つの電極と 2 つの電解質で構成されます。場合によっては、2 つの半電池が同じ電解液を使用することがあります。 2 つの異なる電解質を使用する場合は、電解質間の接触を維持するために塩橋を使用する必要があります。それは、塩橋を通してイオンを移動させる通路を作ることによって行われます。電子は、外部回路を介して半分のセルからもう一方のセルに流れます。 2 つの電極は陽極と陰極と呼ばれます。
酸化反応と還元反応は 2 つの電極で別々に起こります。酸化反応は陽極で起こり、還元反応は陰極で起こります。したがって、電子はアノードで生成され、外部回路を介してアノードからカソードに移動します。塩橋は、電荷のバランスをとるためにイオンを通過させることにより、システムを (電気的に) ニュートラルに維持するのに役立ちます.
次の電気化学セルを考えてみましょう。
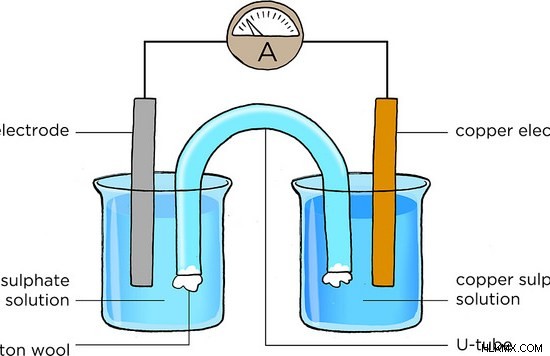
図 1:電気化学セル
ここで、陽極は Zn (亜鉛) 電極、陰極は Cu (銅) 電極です。酸化反応はZn電極で起こります。そこで、金属Znは酸化されてZnイオンになる。放出された電子は、外部ワイヤを通過します。生成された Zn イオンは溶液中に放出されます。したがって、Zn 電極は時間とともに溶解します。還元反応は陰極付近で起こります。カソードは Cu 電極です。そこでは、外部回路からの電子が溶液中の Cu イオンに取り込まれ、Cu 金属に還元されます。したがって、Cu電極の質量は時間とともに増加します。外部ワイヤを通る電子の流れは、酸化還元反応から生成される電流として測定できます。これは、電気化学セルの典型的な構造です。
リアクション
- 陽極での反応 (酸化)
Zn(s) → Zn(aq) + 2e
- 陰極での反応 (還元)
Cu(aq) + 2e → Cu(s)
電解セルとは
電解セルは、電気エネルギーを使用して化学反応を起こす電気化学セルの一種です。つまり、電気エネルギーは外部から供給されなければなりません。その後、非自発的な反応が開始される可能性があります。電解セルは、化合物の電気分解に最も一般的に使用されます。
電解槽も電極として固体金属で構成されています。外部回路に接続された 2 つの電極があります。一方の電極は陽極として機能し、もう一方の電極は陰極として機能します。陽極では酸化反応が起こり、陰極では還元反応が起こります。
外部の電気エネルギー供給 (2 つの電極に接続されたバッテリーから) は、カソードを通る電子の流れを提供します。これらの電子は電解液に入ります。次に、溶液中の陽イオンが陰極の周りに集まり、陰極を通って来る電子を取得します。したがって、これらの陽イオンは陰極で還元されます。陰極の電子は、溶液中の陰イオンをはじきます。これらの陰イオンは陽極に向かって移動します。そこで、これらの陰イオンは電子を放出し、酸化されます。したがって、陽極は正電荷を持ち、陰極は負電荷を持ちます。
次の例を考えてみましょう。
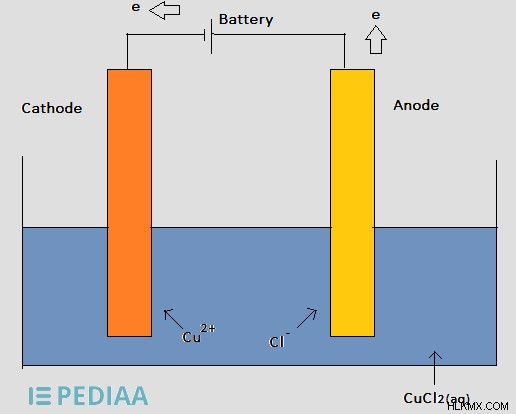
図 2:塩化銅溶液の電気分解
上記の電解セルでは、バッテリーがカソードに電子を供給し、Cu イオンがカソードの周りに集まり、カソードから電子を奪います。次に、Cu イオンは Cu 金属に還元され、カソード上に堆積します。その後、Cl イオンは陽極に向かって移動し、余分な電子を放出します。そこでは、Cl の酸化が起こり、Cl
リアクション
- 陽極での反応 (酸化)
2Cl(aq) → Cl2(g) + 2e
- 陰極での反応 (還元)
Cu(aq) + 2e → Cu(s)
電気化学セルと電解セルの違い
定義
電気化学セル: 電気化学セルは、自発的な化学反応によって電気エネルギーを生成できるシステムです。
電解セル: 電解セルは、電気エネルギーを使用して化学反応を起こす電気化学セルの一種です。
エネルギー変換
電気化学セル: 電気化学セルでは、化学エネルギーが電気エネルギーに変換されます。
電解セル: 電解セルでは、電気エネルギーが化学エネルギーに変換されます。
外部電流
電気化学セル: 電気化学セルは、外部の電気エネルギー源を必要としません。
電解セル: 電解セルには、外部の電気エネルギー源が必要です。
化学反応
電気化学セル: 電気化学セルでは、自発的な化学反応が起こります。
電解セル: 電解セルでは、非自発的な化学反応が起こります。
電極
電気化学セル: 電気化学セルでは、アノードがマイナス、カソードがプラスです。
電解セル: 電解槽では、陽極がプラスで陰極がマイナスです。
電子の動き
電気化学セル: 電子は、電気化学セル内でアノードからカソードに渡されます。
電解セル: 電子はバッテリーからカソードに渡され、次に電子は電解セルの電解液を通ってアノードに入ります。
結論
電解セルは、電気化学セルの一種です。したがって、電解セルは、典型的な電気化学セルが持つすべてのコンポーネントで構成されています。電気化学セルと電解セルの両方が、システムを通る電子の循環を伴います。ただし、電気化学セルでは自発的な化学反応が発生しますが、電解セルでは非自発的な化学反応が発生します。これが電気化学セルと電解セルの違いです。