主な違い - 分子性と反応順序
化学反応の速度は、主にシステムの温度と圧力、存在する反応物質の濃度、触媒の有無、および反応物質の性質に依存します。ただし、反応速度は、速度決定ステップを考慮して計算されます。化学反応には 1 つのステップしかないものもあれば、いくつかのステップで起こる反応もあります。その場合、反応速度は最も遅いステップによって決定されます。分子性と反応順序は、反応速度に関して使用される 2 つの用語です。分子量と反応順序の主な違いは m 分子性は理論的な概念ですが、反応の順序は実験的に決定できます。
対象となる主な分野
1.分子性とは
– 定義、例による説明
2.反応の順序とは
– 定義、例による説明
3.分子性と反応順序の違いは何ですか
– 主な相違点の比較
重要な用語:二分子、一次反応、分子性、反応の順序、二次反応、三分子、単分子、 ゼロ次反応

分子性とは
分子数は、律速段階に関与する分子またはイオンの数です。律速段階は、反応機構の他の段階の中で最も遅い段階です。最も遅いステップの速度が増加すると、全体の反応速度が増加するため、最も遅いステップは速度決定ステップと見なされます。反応の分子性は、律速段階に関与する分子またはイオンの数に従って命名されます。
単分子反応
単分子反応では、1 つの分子が変化します。次に、速度決定ステップの式には 1 つの反応物しかありません。
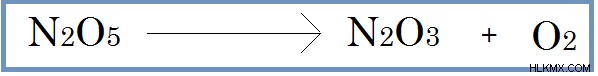
図 01:N2 の変換 O5 N2に O3 そしてO2 単分子です
二分子反応
これらの反応には、律速段階で 2 つの反応物が関与します。

図 2:二分子反応
三分子反応
これらの反応には、化学反応の律速段階で 3 つの反応物が関与します。
反応の順序とは
反応の次数は、速度法則の式で反応物濃度が上昇する累乗の合計として定義できます。速度法則は、反応物濃度と速度定数などの定数パラメーターを使用して反応速度を与える方程式です。
反応の次数は、速度法則の指数の合計です。反応の順序は、各反応物の化学量論係数と等しくても等しくなくてもよい。したがって、反応の順序は実験的に決定する必要があります。反応次数は、反応速度に関する定量的測定値です。分子量とは異なり、反応の順序は分数値または整数で指定できます。反応の次数がゼロになることもあります。これは、反応速度が反応物の濃度に依存しないことを意味します。例を考えてみましょう。
aA + bB + cC → dD + eE
上記の反応の速度法則は、
R =k [A][B][C]
どこで、
R は反応率です
A、B、C は反応物です
P、q、r は、それぞれ A、B、C に対する反応の順序です。
反応の次数は、p+q+r の合計に等しくなります。
p、q、r の値は、実験的に決定する必要があります。場合によっては、これらの値が各反応物の化学量論係数と等しくなる場合もありますが、そうでない場合もあります。反応の順序は、速度決定または最も遅いステップだけでなく、全体的な反応を考慮して計算されます。反応の順序によると、いくつかのタイプの反応が存在する可能性があります。
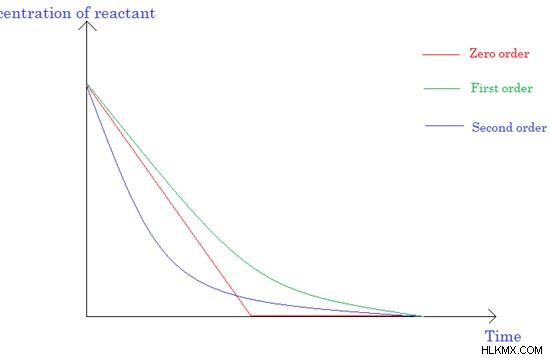
図 3:反応物濃度と反応時間のグラフ
ゼロ次反応
ゼロ次反応の速度は、反応物の濃度とは無関係です。
一次反応
一次反応では、反応速度は 1 つの反応物の濃度に依存します。これは単分子反応に相当します。
二次反応
二次反応の反応速度は、1 つの二次反応物質または 2 つの一次反応物質の濃度に依存する場合があります。
分子性と反応順序の違い
定義
分子性: 分子量は、律速段階に関与する分子またはイオンの数です。
反応の順序: 反応の次数は、速度法則式で反応物濃度が上昇する累乗の合計です。
レート決定ステップ
分子性: レート決定ステップは、分子量を取得するために使用されます。
反応の順序: 全体的な反応は、反応の順序を取得するために使用されます。
値
分子性: 分子性は常に整数です。
反応の順序: 反応の次数はゼロ、整数、または分数です。
決意
分子性: 分子量は、反応メカニズムを見て決定されます。
反応の順序: 反応の順序は、実験方法によって決定されます。
結論
分子性と反応順序は、化学反応の速度を説明するために使用される 2 つの異なる用語です。反応機構から分子量を求めます。反応の次数は、反応速度則から得られます。分子性と反応順序の違いは、分子性は理論的概念であるのに対し、反応順序は実験的に決定されることです。







