主な違い - 原子価結合理論と分子軌道理論
原子は、電子が存在する軌道で構成されています。これらの原子軌道は、さまざまな形とさまざまなエネルギー準位で見つけることができます。原子が他の原子と結合して分子内にある場合、これらの軌道は異なる方法で配置されます。これらの軌道の配置は、分子の化学結合と形状または幾何学を決定します。これらの軌道の配置を説明するために、原子価結合理論または分子軌道理論のいずれかを使用できます。原子価結合理論と分子軌道理論の主な違いは、原子価結合理論では軌道の混成を説明するのに対し、分子軌道理論では軌道の混成に関する詳細が説明されないことです。
対象となる主な分野
1.原子価結合理論とは
– 定義、理論、例
2.分子軌道理論とは
– 定義、理論、例
3.原子価結合理論と分子軌道理論の違いは何ですか
– 主な相違点の比較
重要な用語:反結合分子軌道、結合分子軌道、混成、混成軌道、分子軌道理論、Pi 結合、シグマ結合、 sp軌道、spOrbital、spOrbital、spdOrbital、原子価結合理論 
原子価結合理論とは
原子価結合理論は、分子内の原子の化学結合を説明するために使用される基本的な理論です。原子価結合理論は、軌道の重なりによる電子のペアリングを説明します。原子軌道は主にs軌道、p軌道、d軌道として見られます。原子価結合理論によれば、2 つの s 軌道の重なり、または p 軌道の頭と頭の重なりがシグマ結合を形成します。 2 つの平行な p 軌道が重なると、パイ結合が形成されます。したがって、単結合にはシグマ結合のみが含まれますが、二重結合にはシグマ結合とパイ結合が含まれます。三重結合には、2 つのパイ結合とともにシグマ結合が含まれる場合があります。
H2 などの単純な分子 水素 (H) 原子は s 軌道のみで構成されているため、軌道の重なりだけでシグマ結合を形成します。しかし、不対電子を持つ s 軌道と p 軌道で構成される原子の場合、原子価結合理論には「ハイブリダイゼーション」として知られる概念があります。
軌道の混成により混成軌道が生成されます。これらの混成軌道は、これらの軌道間の反発が最小になるように配置されています。以下はいくつかの混成軌道です。
sp軌道
この混成軌道は、s 軌道と p 軌道が混成したときに形成されます。したがって、sp 軌道は、s 軌道の特性の 50% と p 軌道の特性の 50% を持ちます。 sp混成軌道で構成される原子には、混成されていないp軌道が2つあります。したがって、これらの 2 つの p 軌道は、2 つの pi 結合を形成する平行な方法で重なり合うことができます。混成軌道の最終的な配置は線形です。
spオービタル
この混成軌道は、s 軌道と 2 つの p 軌道の混成から形成されます。したがって、この sp 混成軌道は、s 軌道特性の約 33% と p 軌道特性の約 67% を構成します。このタイプのハイブリダイゼーションを受ける原子は、1 つのハイブリダイズしていない p 軌道で構成されます。混成軌道の最終的な配置は三方平面です。
spオービタル
この混成軌道は、s 軌道と 3 つの p 軌道の混成から形成されます。したがって、この sp 混成軌道は、s 軌道の特性の約 25% と p 軌道の特性の約 75% を含んでいます。このタイプのハイブリダイゼーションを受ける原子には、ハイブリダイズしていない p 軌道はありません。混成軌道の最終的な配置は四面体です。
spdオービタル
この混成には、s 軌道、3 つの p 軌道、および d 軌道が含まれます。
これらの混成軌道は、分子の最終的な形状または形状を決定します。

図 1:CH4 の形状は四面体です
上の画像は CH4 のジオメトリを示しています 分子。四面体です。灰色の軌道は炭素原子の sp 混成軌道ですが、青色の軌道は共有結合を形成する炭素原子の混成軌道と重なった水素原子の s 軌道です。
分子軌道理論とは
分子軌道理論は、仮想分子軌道を使用して分子の化学結合を説明します。また、原子軌道が重なり合う(混合する)と分子軌道がどのように形成されるかについても説明します。この理論によると、分子軌道は最大 2 つの電子を保持できます。これらの電子は、それらの間の反発を最小限に抑えるために反対のスピンを持っています。これらの電子は結合電子対と呼ばれます。この理論で説明されているように、分子軌道には結合分子軌道と反結合分子軌道の 2 種類があります。
結合分子軌道
結合分子軌道は、原子軌道(この分子軌道の形成に関与した原子軌道)よりも低いエネルギーを持っています。したがって、結合軌道は安定しています。結合分子軌道には記号 σ が与えられます。
反結合分子軌道
反結合性分子軌道は、原子軌道よりも高いエネルギーを持っています。したがって、これらの反結合軌道は、結合軌道や原子軌道と比較して不安定です。反結合性分子軌道には、記号 σ* が与えられます。
結合分子軌道は、化学結合の形成を引き起こします。この化学結合は、シグマ結合またはパイ結合のいずれかです。反結合性軌道は、化学結合の形成には関与しません。それらは結合の外に存在します。シグマ結合は、頭と頭が重なり合うときに形成されます。パイ結合は軌道の内側と外側の重なりで形成されます。
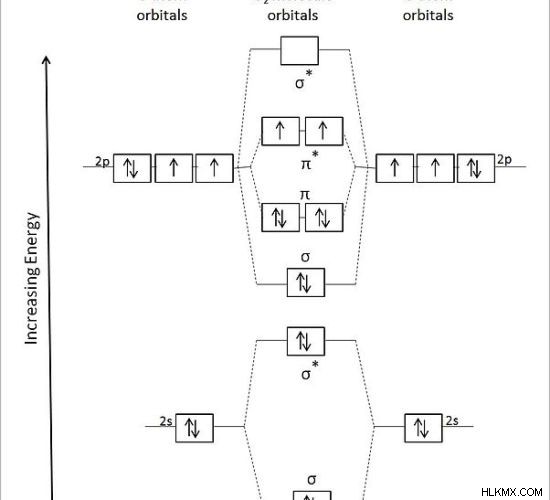
図 2:酸素分子の結合の分子軌道図
上の図では、2 つの酸素原子の原子軌道が左側と右側に示されています。真ん中はO2の分子軌道 分子は結合軌道と反結合軌道として表示されます。
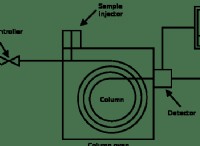
原子価結合理論と分子軌道理論の違い
定義
原子価結合理論 :原子価結合理論は、分子内の原子の化学結合を説明するために使用される基本的な理論です。
分子軌道理論: 分子軌道理論は、仮想分子軌道を使用して分子の化学結合を説明します。
分子軌道
原子価結合理論 :原子価結合理論では、分子軌道に関する詳細はわかりません。原子軌道の結合について説明します。
分子軌道理論: 分子軌道理論は、分子軌道に基づいて展開されます。
軌道の種類
原子価結合理論 :原子価結合理論は混成軌道を記述します。
分子軌道理論: 分子軌道理論は、結合分子軌道と反結合分子軌道を記述します。
ハイブリダイゼーション
原子価結合理論 :原子価結合理論は、分子軌道の混成を説明します。
分子軌道理論: 分子軌道理論は、軌道の混成について説明していません。
結論
分子内の原子間の化学結合を説明するには、原子価結合理論と分子軌道理論の両方が使用されます。しかし、原子価結合理論は、複雑な分子の結合を説明するために使用することはできません。二原子分子に非常に適しています。しかし、分子軌道理論を使用して、任意の分子の結合を説明できます。したがって、原子価結合理論よりも多くの高度なアプリケーションがあります。これが原子価結合理論と分子軌道理論の違いです。
参考文献:
1. 「絵画的分子軌道理論」。化学LibreTexts。 Libretexts、2016 年 7 月 21 日。ウェブ。こちらから入手できます。 2017 年 8 月 9 日.
2. 「原子価結合理論と混成原子軌道」。原子価結合理論と混成原子軌道。 N.p.、n.d.ウェブ。こちらから入手できます。 2017 年 8 月 9 日。
画像提供:
1. 英語版ウィキペディアの K. Aainsqatsi による「Ch4 ハイブリダイゼーション」(原文:K. Aainsqatsi) – 自身の作品 (原文:自作) (パブリック ドメイン)、Commons Wikimedia 経由
2. 「酸素分子軌道図」Anthony.Sebastian 著 – (CC BY-SA 3.0) Commons Wikimedia 経由