主な違い – 混成軌道と分子軌道
軌道は、電子で満たすことができる仮説上の構造です。さまざまな発見によると、科学者はこれらの軌道のさまざまな形状を提案しています。軌道には、主に原子軌道、分子軌道、混成軌道の 3 種類があります。原子軌道は、原子核の周りにある仮想軌道です。分子軌道は、2 つの原子がそれらの間で共有結合を作成するときに形成される仮想軌道です。混成軌道は、原子軌道の混成により形成される仮想軌道です。混成軌道と分子軌道の主な違いは、混成軌道は同じ原子内の原子軌道の相互作用によって形成されるのに対し、分子軌道は 2 つの異なる原子の原子軌道の相互作用によって形成されることです。
対象となる主な分野
1.ハイブリッド軌道とは
– フォーメーション、シェイプ、プロパティ
2.分子軌道とは
– フォーメーション、シェイプ、プロパティ
3.混成軌道と分子軌道の類似点は何ですか
– 共通機能の概要
4.混成軌道と分子軌道の違いは何ですか
– 主な相違点の比較
重要な用語:反結合分子軌道、原子軌道、結合分子軌道、ハイブリダイゼーション、ハイブリッド軌道、分子軌道

ハイブリッド軌道とは
ハイブリッド軌道は、共有結合を作るために同じ原子内の原子軌道が混合されて形成される仮想軌道です。言い換えれば、原子の原子軌道は混成を受けて、化学結合に適した軌道を作ります。原子軌道には、s 軌道、p 軌道、d 軌道、f 軌道があります。 2 つ以上の軌道が混成すると、新しい混成軌道が形成されます。混成軌道は、混成を受ける原子軌道に従って名前が付けられます。以下にいくつかの例を示します。
spハイブリッド軌道
これらの軌道は、1 つの s 軌道と 1 つの p 軌道が混合されて形成されます。結果として得られる混成軌道は、s 特性の 50% と p 特性の 50% を持ちます。 sp軌道の空間配置は線形です。したがって、これらの軌道間の結合角は 180° です。 sp ハイブリダイゼーションを受ける原子には、2 つの空の p 軌道があります。
sp ハイブリッド軌道
これらの軌道は、1 つの s 軌道と 2 つの p 軌道が混成したときに形成されます。結果として得られる混成軌道には、約 33% の s 文字と約 66% の p 文字があります。これらの軌道の空間配置は三角平面です。したがって、これらの軌道間の結合角は 120°C です。このハイブリダイゼーションを受ける原子には、空の p 軌道が 1 つあります。
sp軌道
これらの軌道は、1 つの s 軌道と 3 つの p 軌道が混成したときに形成されます。結果として得られる混成軌道には、約 25% の s 文字と約 75% の p 文字があります。これらの軌道の空間配置は四面体です。したがって、これらの軌道間の結合角は 109.5C です。このハイブリダイゼーションを受ける原子には、空の p 軌道はありません。
spd軌道
これらの軌道は、1 つの s 軌道、3 つの p 軌道、および 1 つの d 軌道が混成したときに形成されます。これらの軌道の空間配置は三角平面です。このハイブリダイゼーションを受ける原子には、4 つの空の d 軌道があります。
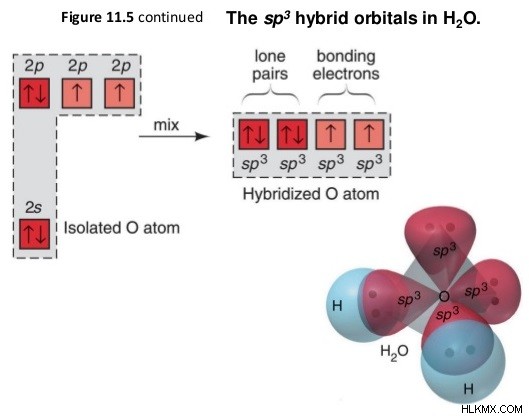
図 1:H2 の sp ハイブリダイゼーション O分子
上の画像は、2 つの水素原子と 2 つの共有結合を形成するための、酸素分子の原子軌道の混成を示しています。
分子軌道とは
分子軌道は、異なる原子の原子軌道が混ざり合う (重なり合う) ことによって形成される仮想軌道です。これは、2 つの原子間に共有結合が形成されたときに発生します。例えば、A原子とB原子の間に共有結合が形成されると、正しい対称性を持つ原子軌道が混ざり合い、分子軌道が形成されます。したがって、分子軌道は、結合電子の大部分が 2 つの原子間に存在する領域です。分子軌道には、結合軌道と反結合軌道の 2 種類があります。
分子軌道の結合
これらの軌道は、分子軌道の形成を受ける原子軌道と比較するとエネルギーが低くなります。したがって、これらの軌道は安定しています。結合電子対はこの軌道にあります。
反結合分子軌道
これらの軌道は、原子軌道や結合分子軌道よりも高いエネルギーを持っています。したがって、それらは安定性が低くなります。ほとんどの場合、これらの軌道は空です。
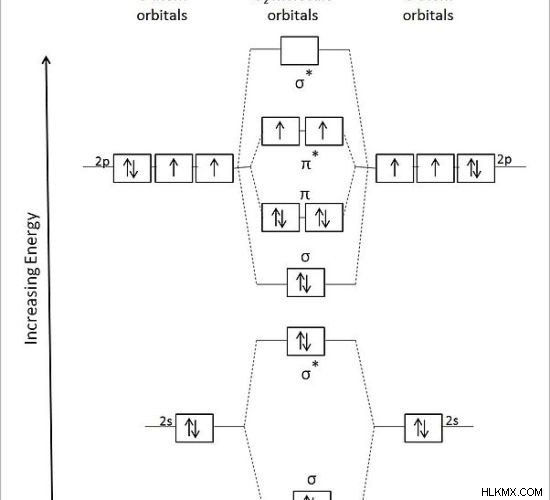
図 2:O2 の分子軌道図 分子
上の画像は、二原子酸素の分子軌道図を示しています。記号「σ」はシグマ結合分子軌道を示し、「σ*」は反結合軌道を示します。
混成軌道と分子軌道の類似点
- 原子軌道の混合により、混成軌道と分子軌道が形成されます。
- どちらのタイプの軌道も、結合電子対の最も可能性の高い位置を示しています。
ハイブリッド軌道と分子軌道の違い
定義
ハイブリッド軌道: 混成軌道は、共有結合を作るために同じ原子内の原子軌道の混合によって形成される仮想軌道です。
分子軌道: 分子軌道は、異なる原子の原子軌道の混合 (重なり) によって形成される仮想軌道です。
原子
ハイブリッド軌道: 混成軌道は同じ原子内で形成されます。
分子軌道: 分子軌道は 2 つの原子間で形成されます。
反結合軌道
ハイブリッド軌道: 混成軌道は、反結合性軌道に関する情報を提供しません。
分子軌道: 分子軌道は、反結合性軌道に関する情報を提供します。
結論
混成軌道と分子軌道はどちらも、原子内または原子間で最も可能性の高い電子の位置を示す仮想軌道です。それらは、分子の形状を予測する上で非常に重要です。混成軌道と分子軌道の主な違いは、混成軌道は同じ原子内の原子軌道の相互作用によって形成されるのに対し、分子軌道は 2 つの異なる原子の原子軌道の相互作用によって形成されることです。







