主な違い - 一塩基酸、二塩基酸、三塩基酸
酸は、酸性の性質を持つ化合物です。酸は、塩と水を形成する塩基と反応できる化学種として定義することもできます。酸には主に強酸と弱酸の 2 種類があります。酸は、一塩基酸、二塩基酸、三塩基酸の 3 つのグループに分類することもできます。酸は、塩基と反応するために持っているプロトンの数に応じてグループ化されます。二塩基酸と三塩基酸を合わせて多塩基酸と呼びます。これらの一塩基酸および多塩基酸は、強酸または弱酸のいずれかです。一塩基二塩基酸と三塩基酸の主な違いは、一塩基酸には置換可能な水素原子が 1 つしかなく、二塩基酸には置換可能な水素原子が 2 つあるのに対し、三塩基酸には置換可能な水素原子が 3 つあることです。
対象となる主な分野
1.一塩基酸とは
– 定義、解離、および例
2. 二塩基酸とは
– 定義、解離、および例
3.三塩基酸とは
– 定義、解離、および例
4.一塩基二塩基酸と三塩基酸の違いは何ですか
– 主な相違点の比較
重要な用語:酸、二塩基酸、一塩基酸、塩、三塩基酸

一塩基酸とは
一塩基酸は、1 つの酸分子あたり 1 つの置換可能な水素原子を持つ酸性化合物です。水溶液では、これらの酸は 1 つのプロトン (水素原子) を除去できます。したがって、これらはモノプロトン酸と呼ばれます .一塩基酸は、一塩基酸と塩基の間の反応に水素原子を 1 つだけ供与できます。
一塩基酸の解離によって系に水素原子が 1 つだけ供与されるため、一塩基酸の解離定数の式には、1 つの H イオンのみの濃度が含まれます。一塩基酸の解離は、次のように示すことができます。
HA(aq) → H(aq) + A(aq)
または
HA(aq) + H2 O(l) → A(aq) + H3 O(aq)
解離定数 Ka =[H(aq) ][ A(aq) ] / [HA(aq) ] 
図 1:塩酸の構造 (水素原子は赤で示されています)
有機および無機の一塩基酸があります。強酸もあれば弱酸もあります。 HCl、HNO3 などの強い一塩基酸 、HBr は完全に解離し、1 つの水素を塩基に供与することができます。酢酸 (CH3 COOH) は部分的に解離しています。
二塩基酸とは
二塩基酸は、酸分子あたり 2 つの置換可能な水素原子を持つ化合物です。したがって、これらの二塩基酸は、二塩基酸と塩基の間の反応のために 2 つの水素原子を供与できます。水溶液では、二塩基酸が解離して、システムに 2 つの水素イオン (H) が提供されます。したがって、これらはジプロトン酸とも呼ばれます .
二塩基酸の解離は次のように与えられます。二塩基酸には 2 つの解離定数値があります。これらは、最初の解離と 2 番目の解離用です。
H2 B(aq) → 2H(aq) + B(aq)
または
H2 B(aq) → H(aq) + HB(aq); Ka1
HB(aq) → H(aq) + B(aq); Ka2
解離定数 Ka1 =[H(aq) ][ HB(aq) ] / [H2 B(aq) ]
解離定数 Ka2 =[H(aq) ][ B(aq) ] / [HB(aq) ] 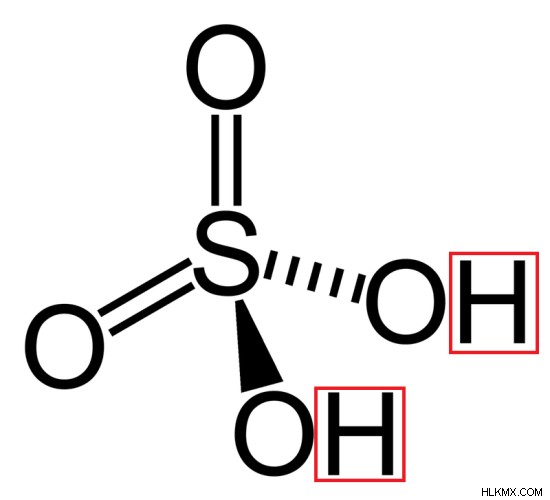
図 2:硫酸の構造 (2 つの水素原子は赤で示されています)
二塩基酸には、強二塩基酸と弱二塩基酸の 2 種類があります。強い二塩基酸は、2 つの水素原子と酸の共役イオンに完全に解離します。それらの最初のイオン化は強力です。しかし、弱い二塩基酸は、部分的に 2 つの水素原子と酸の共役イオンに解離します。二塩基酸の一般的な例としては、H2 などがあります。 SO4 、H2 CO3 と H2 C2 O4 .
三塩基酸とは
三塩基酸は、3 つの置換可能な水素原子を持つ化合物です。これらの酸は、三塩基酸と塩基の間の反応に 3 つの水素イオンを提供できます。 3 つの H イオン (陽子) を除去できるため、これらの酸は 三塩基酸 とも呼ばれます。 .
三塩基酸の解離により、システムに 3 つの水素イオンが提供されます。したがって、三塩基酸の解離には 3 つの解離定数があります。
H3 C(aq) → 3H(aq) + C(aq)
または
H3 C(aq) → H(aq) + H2 C(aq); Ka1
H2 C(aq) → H(aq) + HC(aq); Ka2
HC(aq) → H(aq) + C(aq); Ka3
解離定数、Ka1 =[H(aq) ][ H2 C(aq) ] / [H3 C(aq) ]
解離定数、Ka2 =[H(aq) ][ HC(aq) ] / [H2 C(aq) ]
解離定数、Ka3 =[H(aq) ][ C(aq) ] / [HC(aq) ] 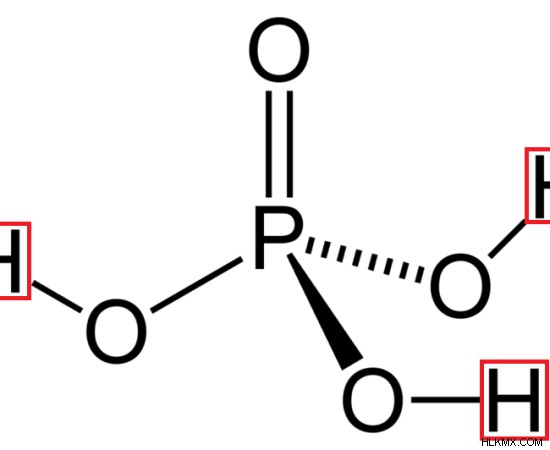
図 3:リン酸の構造 (3 つの水素原子は赤で示されています)
一般的な無機三塩基酸はリン酸 (H3 PO4 )。それは、リン原子の周りの3つの酸素原子に結合した3つの水素原子で構成されています。これらの水素原子は、分子から置換または除去できます。一般的な有機三塩基酸はクエン酸です。
一塩基二塩基酸と三塩基酸の違い
定義
一塩基酸: 一塩基酸は、酸分子あたり 1 つの置換可能な水素原子を持つ酸性化合物です。
二塩基酸: 二塩基酸は、酸分子あたり 2 つの置換可能な水素原子を持つ化合物です。
三塩基酸: 三塩基酸は、酸分子あたり 3 つの置換可能な水素原子を持つ化合物です。
酸塩基反応に供与される水素イオン
一塩基酸: 一塩基酸は、酸塩基反応のために 1 つの水素イオンのみを供与できます。
二塩基酸: 二塩基酸は、酸塩基反応のために 2 つの水素イオンを供与できます。
三塩基酸: 三塩基酸は、酸塩基反応のために 3 つの水素イオンを供与できます。
解離
一塩基酸: 一塩基酸には段階的な解離はありません。
二塩基酸: 二塩基酸は 2 段階で解離します。
三塩基酸: 三塩基酸は 3 つのステップで解離します。
解離定数
一塩基酸: 一塩基酸の解離定数は 1 つだけです。
二塩基酸: 二塩基酸には 2 つの解離定数があります。
三塩基酸: 三塩基酸には 3 つの解離定数があります。
結論
酸は、システムにプロトン (または H イオン) を放出できる化合物です。したがって、酸の存在は、そのシステムの低い pH 値によって示されます。システムの酸性度は、そのシステムに存在する酸の種類に依存します。酸は主に強酸と弱酸に分類されます。これらの酸が酸塩基反応のために供与するプロトンの数に応じて、酸は一塩基酸と多塩基酸としてグループ化することもできます。二塩基酸と三塩基酸は多塩基酸です。一塩基二塩基酸と三塩基酸の主な違いは、一塩基酸には置換可能な水素原子が 1 つしかなく、二塩基酸には置換可能な水素原子が 2 つあるのに対し、三塩基酸には置換可能な水素原子が 3 つあることです。