主な違い - 原子半径とイオン半径
原子は物質の構成要素です。すべての物質は原子で構成されています。これらの原子は、外部から1つ以上の電子を追加することにより、イオンに変換できます。原子とイオンは円形の 3D 構造であるため、原子またはイオンの半径を測定できます。しかし、それは簡単な作業ではありません。原子またはイオンは、移動中の電子で構成されているためです。原子半径は、原子核とその電子雲の境界との間の距離です。イオン半径は、原子のイオンの半径です。イオンの半径は、イオンの電荷に応じて、原子の半径より大きくなったり小さくなったりします。原子半径とイオン半径の主な違いは、原子半径は中性原子の半径であるのに対し、イオン半径は荷電原子の半径です。
対象となる主な分野
1.原子半径とは
–定義、周期表の傾向
2.イオン半径とは
–定義、周期表の傾向
3. 原子半径とイオン半径の違いは何ですか
– 主な違いの比較
重要な用語:原子半径、原子、電子殻、イオン半径、イオン 
原子半径とは
原子半径は、原子核から電子雲の境界までの距離です。つまり、原子核からその原子に属する最も遠い電子までの距離です。原子半径は、孤立原子と中性原子に対してのみ定義できます。
元素の周期表を考えると、元素の原子半径のパターンがあります。周期表の周期に沿って、原子番号は徐々に減少します。同じ期間の元素は同じ数の電子殻を持っています。存在する電子の数が多い場合、電子と原子核の間の引力も高くなります。周期の初めには、最も外側の軌道に存在する電子の数が少なくなります。その場合、核からの引力は少なくなります。したがって、原子は大きく、原子半径も大きくなります。しかし、周期に沿って移動すると、原子核内の陽子の数は、原子内に存在する電子の数とともに増加します。そのため、電子と原子核の間の引力は高い。原子のサイズが縮小します。その後、原子半径が減少します。同様に、周期に沿って移動すると、原子のサイズが徐々に減少し、原子半径も減少します。
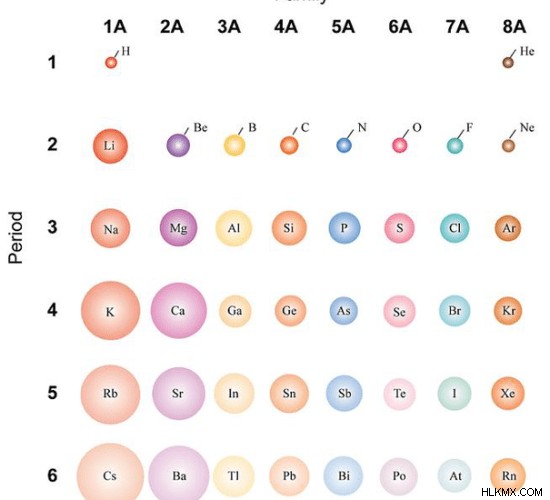
図 1:原子サイズの比較
元素の周期表のグループを下に移動すると、原子半径が増加します。各ピリオドの後、もう 1 つの電子殻が原子に追加されます。したがって、グループを下に移動すると、原子のサイズが大きくなります。原子半径も大きくなります。
しかし、d ブロック要素では、同じ周期内の 2 つの隣接する要素の原子の原子半径に大きな差はありません。これは、ここの電子が、内側の軌道として配置されている同じ d 軌道に追加されるためです。最外殻は一定のままであるため、これらの元素の原子半径に大きな違いはありません。
イオン半径とは
イオン半径は、原子のイオンの半径です。イオンは単独では存在できません。正に帯電したイオンであれば、負に帯電したイオン (またはその逆) と反応し、安定した中性化合物になります。この化合物は、イオン成分からできているため、イオン化合物と呼ばれます。イオン性化合物は、陽イオンと陰イオンで構成されています。カチオンは、原子から 1 つまたは複数の電子を除去することによって形成されるため、サイズが小さくなります。陰イオンは、核によって反発される余分な電子を持っているため大きく、その結果、核と電子雲の最も遠い電子との間の距離が増加します。
イオン半径を見つける最も正確な方法は、2 つのイオンの 2 つの原子核間の距離をそれらのサイズに従って分割することです。たとえば、イオン化合物が陽イオンと陰イオンで構成されている場合、原子サイズが 3 倍大きい場合、陽イオン半径を得るには、2 つの原子核間の距離を 4 で割る必要があります。

図 2:いくつかの元素の原子半径とイオン半径
同じ化学元素のイオンでも、その電荷に応じてさまざまなサイズで見つけることができます。イオン半径を見つける最も一般的な方法は、X 線結晶構造解析です。原子半径と同じように、イオン半径も周期表に傾向があります。周期表のグループを下に移動すると、イオン半径が増加します。これは、グループを下に行くと、周期ごとに新しい電子殻が追加されるためです。ある期間に沿って、原子核からの効果的な正の引力が徐々に増加するため、イオン半径が減少します。
原子半径とイオン半径の違い
定義
原子半径: 原子半径は、中性原子の半径です。
イオン半径: イオン半径は、原子のイオンの半径です。
計算
原子半径: 原子半径は、原子核から電子雲の境界までの距離として計算できます。
イオン半径: イオン半径は、2 つのイオンの 2 つの原子核間の距離をそれらのサイズで割ることによって計算できます。
サイズ
原子半径: 同じ元素の中性原子は同じサイズなので、原子半径は互いに等しくなります。
イオン半径: 陽イオンは陰イオンより原子半径が小さいです。
決意
原子半径: 原子半径は、化学元素の中性気体原子を考慮して決定されます。
イオン半径: イオン半径は、イオン結合 (イオン化合物) にある陽イオンと陰イオンを考慮して決定されます。
結論
化学元素の原子半径とイオン半径は、元素の周期表に傾向があります。周期に沿った、または周期表のグループに沿った原子またはイオンのサイズの増加または減少は、元素の電子配置を使用して説明できます。ただし、原子半径とイオン半径にはかなりの違いがあります。原子半径とイオン半径の主な違いは、原子半径が中性原子の半径であるのに対し、イオン半径は荷電原子の半径であることです。







