正味のイオン方程式を書くには、まず水性成分を構成イオンに分解し、次に方程式の両側に存在するイオン (スペクテーター イオン) を除去する必要があります。
少し前に、バランスの取れた化学式の書き方について説明しました。今日は、さらにレベルアップして、正味のイオン方程式の書き方を学びましょう。
基本的な化学式には、完全な分子形態の反応物と生成物が含まれます。一方、イオン方程式は、反応に関与する水性成分を構成イオンに分解します。正味のイオン方程式は、これをさらに一歩進めて、反応に直接参加し、スペクテーター イオンを捨てるイオンと分子のみを含みます。

イオン式には、完全な分子形態ではなく、水溶液のイオンが組み込まれています。 (写真提供:Erika J Mitchell/Shutterstock)
イオン方程式の書き方
イオン方程式を書く前に、イオン化合物とは何か、そしてそれらがどのように機能するかを知っておく必要があります.
イオン性化合物は、静電気力によって一緒に保持されている反対の電荷を持つイオン (正味の電荷を持つ原子または分子) で構成されています。これらの化合物は、適切な溶媒に溶解すると、その成分イオンに解離します。水が溶媒として使用される場合、その溶液は水溶液と呼ばれます (水は非常に優れた溶媒であり、ほとんどのイオン化合物に対して機能します)。下付き文字 aq でラベル付けされたこれらのソリューションを見たことがあるかもしれません 化学式で。
解離したイオンは、他の反応物のイオンと反応し続け、最終生成物を生成します。
ただし、一部のイオンは化学式の両側に存在し、反応に直接関与しません。これらのイオンはスペクテーター イオンとして知られています (詳細は後述します)。
それでは、正味のイオン方程式の書き方を学びましょう。
ステップ 1:化学式のバランスをとります。
正味のイオン方程式はバランスのとれた化学方程式から導かれるため、先に進む前にバランスのとれた化学方程式が必要です。
化学式のバランスをとるには、式の両側にある各元素の原子数を数えることから始めます。すべての原子が説明されたら、最初に主要な元素のバランスを取ることから始め、その後に水素原子と酸素原子が続きます。
化学式のバランスをとる方法に関するこの簡単な概要がうまくいかない場合は、このトピックに関するより詳細な記事をチェックしてください:バランスのとれた化学式の書き方
たとえば、塩化カリウムと硝酸鉛の反応のバランスの取れた化学式は次のとおりです。
2KCL + Pb(NO3)2 → 2KNO3 + PbCl2
ステップ 2:すべての反応物と生成物の物理的状態を決定する
ここで、方程式に含まれる各反応物と生成物の物理的状態を特定する必要があります。この目的のために、周期表と溶解度表を利用します。溶解度表には、さまざまな陰イオンと陽イオンと、これら 2 つの粒子の組み合わせが水中でどのように作用するかが表示されます。
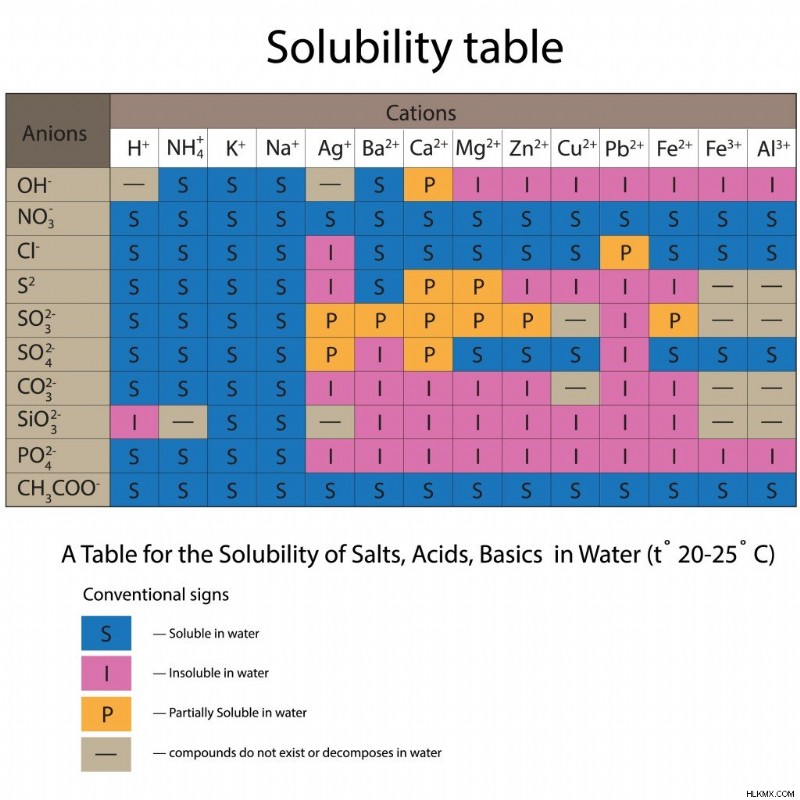
さまざまな陰イオンと陽イオンの水への溶解度表。 (写真提供:yaruna/Shutterstock)
問題文から明らかでない場合は、周期表を参照して、参加者の物理的状態を元素の形で取得してください。化合物 (および塩) が溶液に含まれている場合は、溶解度表で溶解度を確認することから始めます。それらが可溶性である場合は、先に進み、それらの状態を水性と書きます。化合物が溶けない場合は、固体状態で存在する必要があります。また、反応に関与する酸または塩基は水性になります。
溶解度表から、K+ 陽イオンは Cl- 陰イオンと NO3- 陰イオンの両方で水に溶けることがわかります。したがって、化合物KCLおよびKNO3は水性である。 Pb2+ 陽イオンに関しては、NO3– 陰イオンには溶けますが、Cl– 陰イオンには部分的にしか溶けません。したがって、Pb(NO3)2 は水性ですが、PbCl2 は固体として存在します。
各反応物と生成物の物理状態でバランスのとれた化学方程式を書くと、次のようになります。
2KCL(aq) + Pb(NO3)2 (aq) → 2KNO3 (aq) + PbCl2 (s)
ステップ 3:水性化合物を構成イオンに分解
イオン方程式を書くには、水性化合物をそれらの成分イオンに分解する必要があります。水性化合物のみを分解することを忘れないでください。これらは水に溶け、成分イオンに分解されます。非水性参加者はそのままにしておきます。
この例では、KCL は K+ イオンと Cl– イオンに分割され、Pb(NO3)2 は反応物側で Pb2+ と 2NO3– に分解されます。
製品側では、KNO3 は K+ イオンと NO3– イオンに解離します。固体として、PbCl2 はそのまま残ります。
2K+(aq) + 2Cl–(aq) + Pb2+(aq) + 2NO3 – (aq) → 2K+(aq) + 2NO3 –(aq) + PbCl2 (s)
注: 各イオンに、バランスの取れた化学式で固定された化学量論係数を掛けることを忘れないでください。そうしないと、イオンとその電荷のバランスが崩れます。
ステップ 4:スペクテーター イオンを削除する
さて、最後のステップとして、正味のイオン方程式を書くために必要なことは、スペクテーター イオンを取り除くことだけです。前述のように、イオン性化合物が解離してイオンになるとき、他のイオンと反応して生成物を形成するのは一部の化合物のみであり、他のイオンは座って反応を観察します。スポーツ イベントの観客と同じように、これらのイオンは反応に直接参加するのではなく、ただ観戦するだけなので、観客イオンと呼ばれます。他のイオンと反応して生成物を形成するイオンは、プリンシパル イオンまたはプレーヤー イオンと呼ばれることがあります。

スペクテイターに似たスペクテーター イオンは、化学反応に参加しません。
スペクテーター イオンは、化学式の反応物側と生成物側の両方で変化しないように見えます。最も一般的なスペクテーター イオンには、周期表の最初の列のアルカリ金属 (K+ および Na+) と、Cl– および F– などのハロゲンが含まれます。これらのイオンは反応に関与しないため、平衡にも影響しません。
塩化カリウムと硝酸鉛の反応では、K+ イオンと NO3– イオンが両側に存在し、変化しません。これらは観客イオンです。イオン Cl– と Pb2+ は最終生成物 PbCl2 を形成し、プレーヤー イオンです。 K+ と NO3– をキャンセルし、残りの要素で方程式を書き直すだけで、正味のイオン方程式が得られます。
2K+ (aq) + 2Cl–(aq) + Pb2+(aq) + 2NO3 – (aq) → 2K+ (aq) + 2NO3 – (aq) + PbCl2 (s)
方程式を書き直すと、次のようになります。
2Cl–(aq) + Pb2+(aq) → PbCl2 (s)
反応物を並べ替えると、方程式は次のようになります:
Pb2+(aq) + 2Cl–(aq) → PbCl2 (s)
上記の式は、塩化カリウムと硝酸鉛との反応の正味のイオン式と呼ばれ、一次生成物として塩化カリウムが生成されます。
最後の言葉
正味のイオン方程式を単独で書くことは難しくありませんが、さまざまなトピックの知識が必要です。これらには、水溶液、イオン化合物、さまざまな化合物の溶解度、溶解度表の使用方法などが含まれます。
このプロセスの開始時に誤ったバランスの取れた化学式があれば、間違いなく間違った道に進むことになります.したがって、完全にバランスの取れた化学式から始めるようにしてください。