主な違い – 昇華と蒸発
昇華と蒸発は、物質の相転移を説明するために使用される用語です。物質の相は、物質の性質がどこでも均一である物質の形態です。物質の 3 つの主な相は、固相、液相、気相です。相転移とは、物質の相をある相から別の相に変換することです。 昇華とは、固相から気相への物質の転移です。蒸発とは、物質が液相から気相に移行することです。 これが昇華と蒸発の主な違いです。
対象となる主な分野
1.昇華とは
– 定義、メカニズム、例
2.蒸発とは
– 定義、メカニズム、例
3.昇華と蒸発の類似点は何ですか
– 共通機能の概要
4.昇華と蒸発の違いは何ですか
– 主な相違点の比較
重要な用語:蒸発、気相、液相、物質、相、相転移、固相、昇華、三重点
昇華とは
昇華とは、固相から気相への転移です。この相転移の間、物質は液相を通過しません。固体が直接気体になります。この反応は、分子間の化学結合を分解して空気中に放出する必要があるため、吸熱反応です。化学結合が形成されるとエネルギーが放出されるため、それらを切断するにはエネルギーを与える必要があります。したがって、吸熱性です。このエネルギーは、昇華のエンタルピーとして計算されます。
昇華は、物質の三重点よりも低い温度と圧力で発生します。物質の三重点は、物質が 3 つの相 (固相、液相、気相) のすべてで存在する温度と圧力です。三重点より下では、固体の水は昇華し、温度が上昇すると直接気体になり、液相を通過することはありません。

図 1:ドライアイス昇華
昇華の例には、ドライアイスが室温と圧力で二酸化炭素ガスに変化することが含まれます。ナフタレンは、標準の温度と圧力で容易に昇華する有機化合物です。
蒸発とは
蒸発とは、液相から気相への移行です。これは吸熱プロセスです。蒸気を形成するには、液体中の分子間の分子間力を分解する必要があります。この反応にはエネルギーが必要です。したがって、それは吸熱反応です。これは、凝縮の反対の反応です。蒸発は温度に直接関係しています。温度が上昇すると、蒸発速度も上昇します。

図 2:表面からの水の蒸発
液体の蒸発は液体の表面で起こります。液体の表面近くの分子は、液体の中央または底部の分子と比較して、分子間力が小さくなります。したがって、表面の分子は容易に放出されます。これらの分子は、最初に気相に変換されます。
蒸発速度に影響を与える要因はいくつかあります。これらの要因の一部を以下に示します。
- 空気中の物質の濃度 – 空気中の蒸発物質の濃度が高い場合、蒸発はゆっくりと起こります.
- 空気の流量 – 流量が多いほど蒸発が増加します。
- 分子間力 – 分子間力が強ければ、蒸発のエンタルピーは高くなります。その後、蒸発が遅くなります。
- 表面積 – 表面積が大きいと蒸発率が高くなります。
昇華と蒸発の類似点
- 昇華と蒸発はどちらも最後にガスを生成します。
- どちらも吸熱性
- どちらのプロセスでも、分子を解放するために分子間力が分解されます。
昇華と蒸発の違い
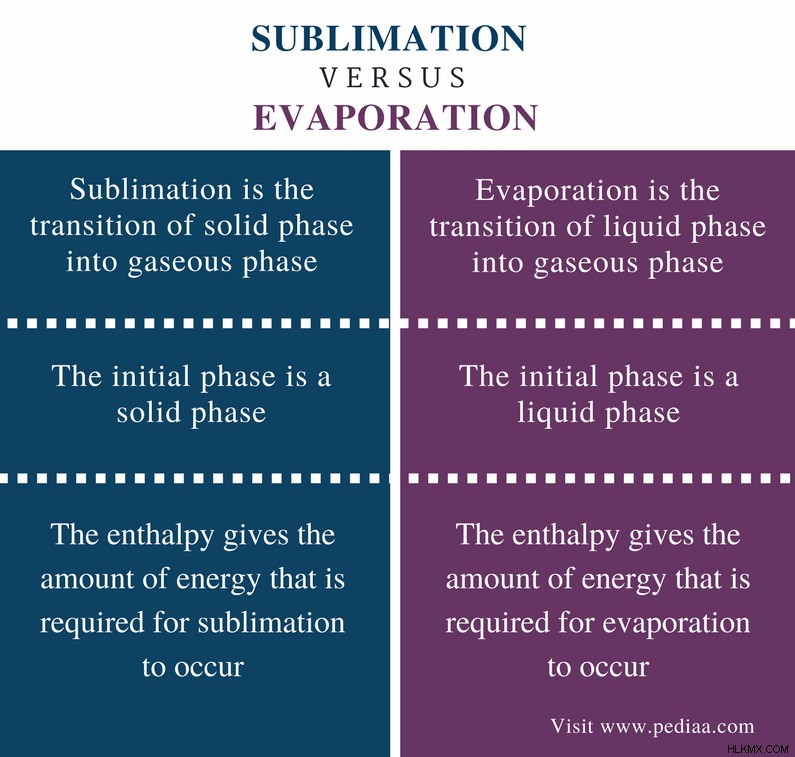
定義
昇華: 昇華とは、固相から気相への転移です。
蒸発: 蒸発とは、液相から気相への移行です。
初期段階
昇華: 昇華の初期段階は固相です。
蒸発: 蒸発の初期段階は液相です。
エンタルピー
昇華: 昇華のエンタルピーは、昇華が発生するために必要なエネルギー量を示します。
蒸発: 蒸発エンタルピーは、蒸発が発生するために必要なエネルギー量を示します。
結論
昇華と蒸発は、物質の相転移に名前を付けるために使用される用語です。これらのプロセスはどちらも物質の気相への変換を表していますが、用語は互いに異なります。昇華と蒸発の主な違いは、昇華が固体から気体への相転移であるのに対し、蒸発は液体から気体への相転移であることです。







