主な違い - 過酸化物とスーパーオキシド
酸化物は、1 つ以上の酸素原子を含む化合物です。酸化物は、酸化物陰イオン (O) を含む酸化物、過酸化物陰イオン (O) を含む過酸化物、またはスーパーオキシド陰イオン (O2 )。過酸化物は、酸素-酸素単結合で構成される任意の化合物です。これは、陰イオンの形であるか、分子の他の原子の間にある場合があります。過酸化水素は、見つけることができる最も単純な過酸化物です。スーパーオキシドは、反応性の高い酸素原子で構成されています。スーパーオキシドは、アルカリ金属 (第 1 族元素) によってのみ形成されます。過酸化物とスーパーオキシドの主な違いは、過酸化物の酸素の酸化状態が -1 であるのに対し、スーパーオキシドの酸素の酸化状態は -1/2 であることです。
対象となる主な分野
1.過酸化物とは
– 定義、構造、例
2.スーパーオキシドとは
– 定義、構造、例
3.過酸化物とスーパーオキシドの違いは何ですか
– 主な相違点の比較
キーワード:アルカリ金属、アルカリ土類金属、陰イオン、結合長、金属、非金属、酸化物、過酸化物、過酸化物陰イオン、ペルオキソ、スーパーオキシド
過酸化物とは
過酸化物は、酸素-酸素単結合で構成される任意の化合物です。したがって、過酸化物化合物を識別する主な特徴は、この O-O 共有結合の存在です。時々、この結合はイオン性化合物の陰イオンとして観察できます。次に、O2 として記号で与えられます。 .これは過酸化物陰イオンと呼ばれます . O-O 結合が共有結合化合物にある場合、ペルオキソ基と呼ばれます または過酸化物基。
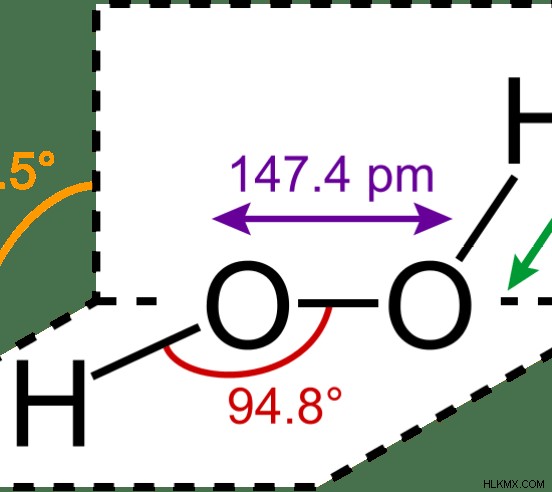
図 1:H2 O2 最も単純な過酸化物です
過酸化物基では、1 つの酸素原子の酸化状態は -1 です。通常、酸素は酸化状態 0 または -2 を示します。しかし、2つの酸素原子が互いに結合しているため、1つの酸素原子は-1の酸化状態になります.過酸化物陰イオンでは、陰イオン全体の電荷が -2 であるため、1 つの酸素原子が -1 の電荷を持っています。
イオン性過酸化物は、陽イオンとしてアルカリ金属イオンまたはアルカリ土類金属イオンに結合した過酸化物陰イオンで構成されます。いくつかの例は、過酸化ナトリウム (Na2 O2 )、過酸化カリウム (K
過酸化物は生物系や自然界に見られます。たとえば、私たちの細胞内の一部の酵素は過酸化物を使用して特定の反応を触媒します。一部の植物種は過酸化物化合物をシグナル伝達物質として使用します。過酸化物は、実験室規模のアプリケーションでも使用されます。有機反応から反マルコフニコフ生成物を得るために、有機化学において非常に有用です.
スーパーオキシドとは
スーパーオキシドは、陰イオン O2 を含む化合物です。 .スーパーオキシド グループでは、1 つの酸素原子の酸化状態は -1/2 です。通常、酸素は酸化状態 0 または -2 を示します。しかし、2つの酸素原子が互いに結合しているため、1つの酸素原子は-1/2の酸化状態になります. スーパーオキシド アニオン 、陰イオン全体の電荷が -1 であるため、1 つの酸素原子は -1/2 の電荷を持っています。
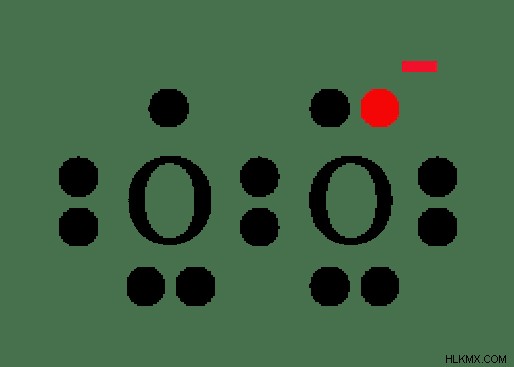
図 2:スーパーオキシド アニオンの化学構造
この陰イオンも O-O 単結合で構成されています。 -1/2 の酸化状態は安定していないため、スーパーオキシド アニオンは非常に反応性が高くなります。スーパーオキシドアニオンは、常磁性を示すフリーラジカルと考えられています。これは、1 つの酸素原子に不対電子が存在するためです (上の画像を参照)。
スーパーオキシドアニオンの O-O 結合の結合距離は約 1.33A です。アルカリ金属のみがスーパーオキシド化合物を形成する傾向があります。それらは、O2 との直接反応によりスーパーオキシド化合物を形成します .アルカリ金属の超酸化物には、NaO2 が含まれます。 、KO2 、RbO2 および CsO2 .ここで、金属は+1の電荷を持っています。それに対応して、化合物を中和するために、陰イオンは -1 の電荷を持つ必要があります。
これらのスーパーオキシド化合物が水に溶解すると、系は急速に不均化します。不均化は、中間の酸化状態の化合物が 2 つの異なる化合物に変換される酸化還元反応です。ここで、スーパーオキシドアニオンと水が反応して O2 を形成します と OH イオン。
4O2 + 2H2 O → 3O2 + 4OH
この反応が、スペースシャトルや潜水艦の化学的酸素発生装置の酸素源としてスーパーオキシド カリウムが使用されている理由です。
過酸化物とスーパーオキシドの違い
定義
過酸化物: 過酸化物は、酸素-酸素単結合で構成される任意の化合物です。
スーパーオキシド: スーパーオキシドは、陰イオン O2 を含む化合物です。 .
化学式
過酸化物: 過酸化物陰イオンの化学式は O2 です。 .
スーパーオキシド: スーパーオキシドアニオンの化学式はO2 .
電荷
過酸化物: 過酸化物イオンの電荷は-2です。
スーパーオキシド: スーパーオキシドイオンの電荷は-1です。
絆の長さ
過酸化物: 過酸化物イオンの O-O 結合長は 1.49°A です。
スーパーオキシド: スーパーオキシドイオンの O-O 結合長は 1.33°A です。
自然
過酸化物: 金属 (アルカリ金属など) と非金属 (水素など) は、過酸化物化合物を形成できます。
スーパーオキシド: スーパーオキシド化合物を形成できるのはアルカリ金属のみです。
例
過酸化物: 過酸化物化合物の例には、Na2O
スーパーオキシド: スーパーオキシド化合物の例には、NaO
結論
過酸化物とスーパーオキシドは、酸素原子を含む酸化物です。過酸化物とスーパーオキシドの主な違いは、過酸化物の酸素の酸化状態が-1であるのに対し、スーパーオキシドの酸素の酸化状態は-1/2であることです。
参照:
1.「12.4:過酸化物とスーパーオキシド」。 Chemistry LibreTexts、Libretexts、2016 年 7 月 21 日、こちらから入手可能。
2.「スーパーオキシド」。ウィキペディア、ウィキメディア財団、2017 年 12 月 15 日、こちらから入手可能。
画像提供:
1. 「H2O2 ガス構造」 SVG 著:Sassospicco;ラスター:Walkerma – ファイル:H2O2 structure.png (GFDL)、コモンズ ウィキメディア経由
2.「スーパーオキシド」(パブリック ドメイン)、コモンズ ウィキメディア経由







