ルイス構造は、分子内の原子と価電子または孤立電子対の間の化学結合を示す図です。ルイス・ドット・ダイアグラム、ルイス・ドット・フォーミュラ、電子ドット・ダイアグラムとも呼ばれます。ルイス構造の名前は、1916 年の論文 The Atom and the Molecule で原子価結合理論とドット構造を紹介した Gilbert N. Lewis に由来します。 .
ルイス構造は、電子が原子の周りにどのように配置されているかを示していますが、説明していません 電子が原子間でどのように共有されるか、化学結合がどのように形成されるか、または分子の形状がどのようなものか。ここでは、ルイス構造を描く方法と、例を示し、図の重要性と制限の両方を見ていきます.
ルイス構造の部分
分子と複合体のルイス構造が描かれています。ルイス構造は、次の部分で構成されています:
- 元素記号
- 価電子を示すドット
- 化学結合を示す線 (単結合は 1 行、二重結合は 2 行など)
- ドットとラインはオクテット規則を満たしています。
- 構造に正味の電荷がある場合、括弧で囲まれ、電荷が右上隅に表示されます
注:「ルイス構造」と「電子ドット構造」という用語は、同じ意味で使用されることがあります。技術的には、それらは少し異なります。ルイス構造は線を使用して化学結合を示しますが、電子ドット構造はドットのみを使用します。
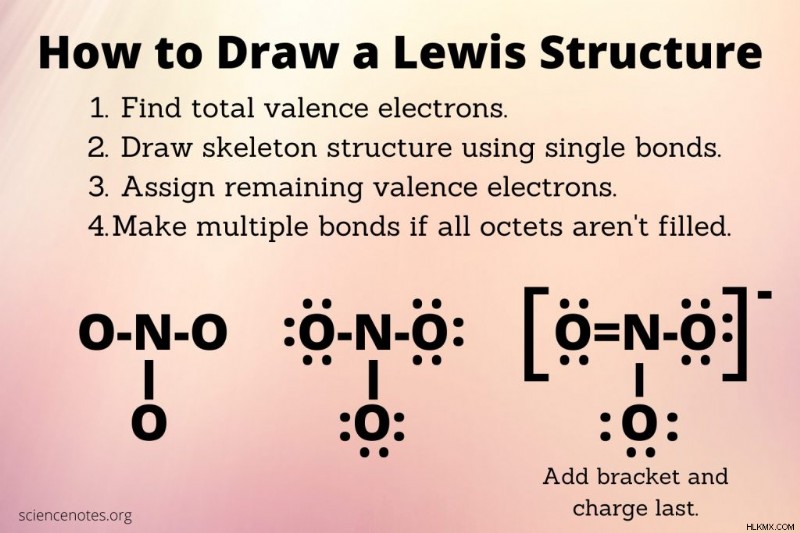
ルイス構造を描く手順
ルイス構造を描くにはいくつかのステップしかありませんが、正しく描くには試行錯誤が必要になる場合があります。
<オール>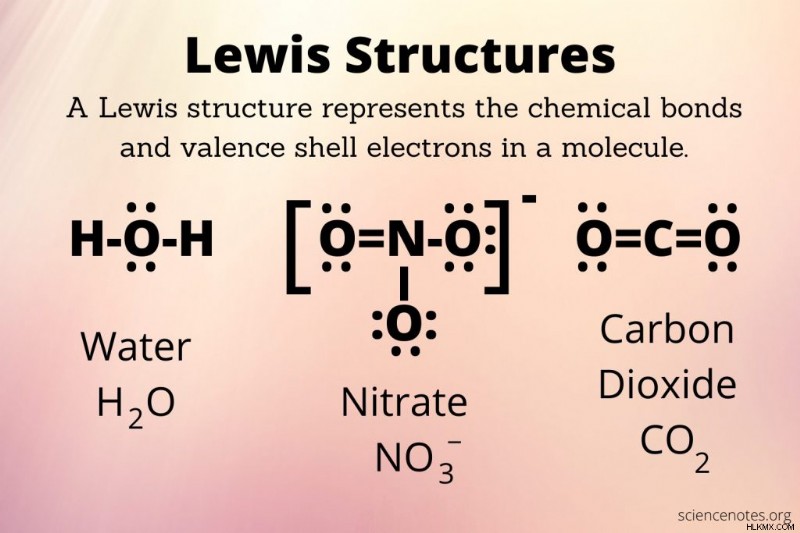
ルイス構造を描くさまざまな方法
ルイス構造を描く「正しい」方法は複数あります。化学の授業で構造を描く場合は、インストラクターが何を期待しているかを確認してください。たとえば、何の幾何学的形状も示さない骨格構造を見ることを好む化学者もいれば、形を見ることを好む化学者もいます (たとえば、水の曲がった形、酸素原子の片側にある角度で非結合電子対がある)。原子とその電子を色で表示するのが好きな人もいます (例:酸素とその電子は赤、炭素とその原子は黒)。
ルイス構造が重要な理由
ルイス構造は、多くの原子が原子価殻を埋めたり半分埋めたりするため、原子価、化学結合、および酸化状態を記述するのに役立ちます。構造によって記述される動作は、8 つの価電子を持つ軽い元素の実際の動作に非常によく似ています。そのため、炭素、水素、酸素の挙動に依存する有機化学や生化学で特に役立ちます。ルイス構造は必ずしも形状を示すわけではありませんが、形状、反応性、および極性を予測するために使用されます。
ルイス構造の限界
一部のアプリケーションでは便利ですが、ルイス構造は完全ではありません。ランタニドやアクチニドのように、分子に 8 個を超える価電子を持つ原子が含まれている場合、それらはうまく機能しません。無機および有機金属化合物は、ルイス構造によって記述されるものを超える結合スキームを使用します。特に、分子軌道は完全に非局在化している可能性があります。ルイス構造は芳香族性を考慮していません。より軽い分子 (O2 、ClO2 、いいえ)、予測された構造は実際の動作と十分に異なるため、ルイス構造は結合長、磁気特性、および結合次数に関する誤った予測につながる可能性があります.
参考文献
- IUPAC (1997)。 「ルイスの公式」。 化学用語集 (「ゴールドブック」)(第2版)。ブラックウェル科学出版物。 ISBN 0-9678550-9-8.
- Lewis, G. N. (1916), “The Atom and the Molecule”. J.午前。化学。社会 . 38 (4):762–85. doi:10.1021/ja02261a002
- 壬生郎、Barnabe B. (1993). 「非科学専攻者向けの簡略化されたルイス構造図」。 J.化学。教育 . 75 (3):317. doi:10.1021/ed075p317
- Zumdahl, S. (2005) 化学原理 .ホートン・ミフリン。 ISBN 0-618-37206-7.







