主な違い – エチレンとアセチレン
エチレンとアセチレンは炭化水素です。それらは、化学的および物理的特性が大きく異なります。エチレンは原油や天然ガスに自然に含まれています。また、果実の成熟を引き起こす植物ホルモンとして植物にも見られます。アセチレンはアルキンです。それは線状分子であり、非常に可燃性です。したがって、燃料として使用されます。アセチレンは、主に製油所での熱分解プロセスによって生成されます。エチレンとアセチレンの主な違いは、エチレンはアルケンであるのに対し、アセチレンはアルキンであることです。
対象となる主な分野
1.エチレンとは
– 定義、化学的性質、製造、用途
2.アセチレンとは
– 定義、化学的性質、製造
3.エチレンとアセチレンの類似点
– 一般的な機能
4.エチレンとアセチレンの違いは何ですか
– 主な相違点の比較
重要な用語:アセチレン、接触分解、原油、エタン、エチレン、エチン、天然ガス、熱分解

エチレンとは
エチレンは、化学式 H2 を持つ最も単純なアルケンです。 C=CH2 .二重結合を介して互いに結合した2つの炭素原子を持っています。無色の可燃性ガスです。エチレンの IUPAC 名は エタン です .この化合物のモル質量は 28.05 g/mol です。融点は-169.2°C、沸点は-103.7°Cです。
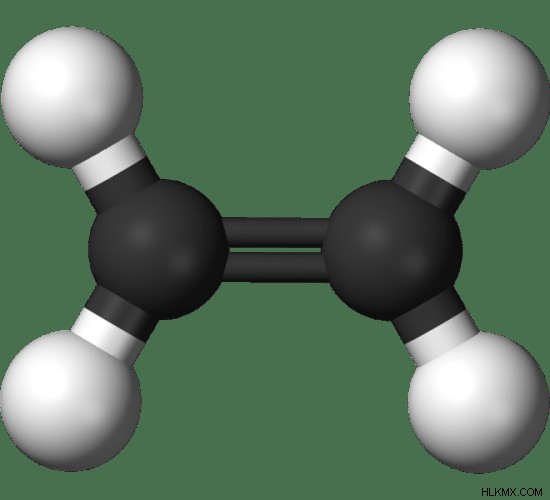
図 1:エチレンの球棒モデル。黒 – 炭素原子、白 – 水素原子
エチレンには甘い味とにおいがあります。エチレンの天然源は原油と天然ガスです。エチレンは、ポリマーなどの重要な化合物を作るために使用されます。エチレン重合によって得られるポリマーには、ポリ(エチレン)、ポリ(クロロエテン)およびポリ(フェニルエテン)が含まれる。エチレンから生成される他の化学物質には、エタノールとエポキシエタンが含まれます。
エチレンには、sp 混成された 2 つの炭素原子があります。炭素原子は、シグマ結合とパイ結合を介して結合されています。各炭素原子は 2 つの水素原子に結合しています。平面分子です。 1 つの炭素原子の周りのジオメトリは、三角形の平面です。パイ結合は、エチレン分子の反応性を担っています。
製造工程
エチレンは分解反応によって生成されます。天然ガスと原油の蒸留から得られる留分は、次の 3 つの主要な分解反応にかけられます。
<オール>エチレンの使用
エチレンの主な用途は、ポリマー製造用のモノマーです。包装目的で使用されるポリエチレンは、エチレンの最も広く使用されている製品の 1 つです。エチレンは、界面活性剤の製造に使用される主要な原料であるエチレンオキシドの製造にも使用されます。また、エチレンは植物ホルモンとして重要です。果実の成熟、開花などを調節します。
アセチレンとは
アセチレンは、化学式 C2 を持つ最も単純なアルキンです。 H2 .三重結合を介して互いに結合した2つの炭素原子が含まれています。炭素原子間には 2 つのパイ結合と 1 つのシグマ結合があります。各炭素原子は、単結合を介して水素原子に結合しています。分子は平面で、1 つの炭素原子の周りの形状は線形です。
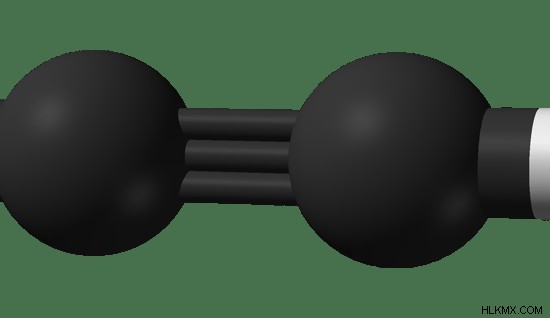
図 2:アセチレンの球棒モデル。黒 – 炭素原子、白 – 水素原子
アセチレンのモル質量は 26.04 g/mol です。その IUPAC 名は エチン です .無色の可燃性ガスです。そのため、ガスとして広く使用されています。ただし、無臭です(エチレンとは異なります)。アセチレンの融点は-80.8°C、沸点は-84°Cです。
大気圧では、アセチレンは液体として存在できません。したがって、実際には融点がありません。したがって、アセチレンの三重点はその融点と見なされます。物質の三重点は、物質の 3 つの相すべてが熱力学的平衡状態で存在する温度です。三重点より低い温度では、固体アセチレンは昇華を起こし、そこで固体アセチレンは直接気相に変換されます。
アセチレンの製造
アセチレンを生成する最も簡単なプロセスは、炭化カルシウムを水と反応させることです。アセチレンガスと炭酸カルシウムのスラリー(消石灰)が得られます。産業上のニーズでは、アセチレンを生成するために 2 つの主な方法が使用されています。
<オール>化学反応プロセスは、前述のように炭化カルシウムからアセチレンを生成するプロセスです。熱分解プロセスは、結合を分解または切断し、再結合して新しい化合物を得る方法です。
エチレンとアセチレンの類似点
- どちらも炭化水素化合物です。
- どちらも室温で無色の気体です。
- どちらも非常に可燃性です。
- どちらも C-H 結合で構成されています。
- どちらも不飽和化合物です。
- どちらも平面構造です。
エチレンとアセチレンの違い
定義
エチレン: エチレンは、化学式 H2 を持つ最も単純なアルケンです。 C=CH2 .
アセチレン: アセチレンは、化学式 C2 を持つ最も単純なアルキンです。 H2 .
カテゴリ
エチレン: エチレンはアルケンです。
アセチレン: アセチレンはアルキンです。
炭素原子間の化学結合
エチレン: エチレンの 2 つの炭素原子の間に二重結合があります。
アセチレン: アセチレンの 2 つの炭素原子の間には三重結合があります。
モル質量
エチレン: エチレンのモル質量は 28.05 g/mol です。
アセチレン: アセチレンのモル質量は 26.04 g/mol です。
IUPAC名
エチレン: エチレンの IUPAC 名はエタンです。
アセチレン: アセチレンの IUPAC 名はエチンです。
融点と沸点
エチレン: エチレンの融点は-169.2°C、沸点は-103.7°Cです。
アセチレン: アセチレンの融点は-80.8°C、沸点は-84°Cです。
臭い
エチレン: エチレンは甘い匂いがします.
アセチレン: アセチレンは無臭です。
ジオメトリ
エチレン: 1 つの炭素原子の周りのジオメトリは、アセチレンでは線形です。
アセチレン: 1 つの炭素原子の周りのジオメトリは、エチレンの三角形の平面です。
結論
エチレンもアセチレンも炭化水素化合物です。それらはそれぞれ最も単純なアルケンとアルキンです。エチレンは自然に見つかりますが、アセチレンは異なる技術的方法を使用して作られています。エチレンとアセチレンの主な違いは、エチレンがアルケンであるのに対し、アセチレンはアルキンであることです。
参照:
1.ラゾンビー、ジョン。 「エテン(エチレン)」エッセンシャル ケミカル インダストリー オンライン。ブリタニカ百科事典、ブリタニカ百科事典、2014 年 12 月 10 日、こちらから入手可能。
3.「アセチレン」。製品の製造方法はこちらから入手できます。
画像提供:
1. Benjah-bmm27 による「エチレン-3D-ボール」 – Commons Wikimedia による自身の作品 (パブリック ドメイン)
2. Ben Mills による「アセチレン-CRC-IR-3D ボール」– 自身の作品 (パブリック ドメイン)コモンズウィキメディア経由