主な違い – プロトン化と脱プロトン化
プロトン化と脱プロトン化は、さまざまな化合物の合成における重要な化学反応です。プロトン化は、化学種へのプロトンの付加です。脱プロトン化は、化合物からプロトンを除去することです。プロトン化と脱プロトン化の主な違いは、プロトン化は化合物に +1 電荷を追加するのに対し、脱プロトン化は化合物から +1 電荷を除去することです。
対象となる主な分野
1.プロトン化とは
– 定義、例
2.脱プロトンとは
– 定義、説明
3.プロトン化と脱プロトン化の違いは何ですか
– 主な相違点の比較
重要な用語:酸、Brønsted-Lowry Acid、脱プロトン化、水素、同位体、プロトン、プロトン化

プロトン化とは
プロトン化は、原子、分子、またはイオンへのプロトンの付加です。プロトンの付加により、化学種の共役酸が形成されます。プロトン化は、化学種の電荷の変化を引き起こします。これは、陽子が常に +1 荷電されているためです。陽子の記号は H として与えられます (+1 荷電水素原子は陽子です)。
水素原子は、プロチウム、重水素、トリチウムの 3 つの主要な同位体として見つけることができます。これらの同位体はすべて、さまざまな数の中性子とともに、核内に 1 つの陽子を持っています。これらの同位体はすべて、周囲の電子殻 (軌道) に 1 つの電子を持っています。この電子が水素原子から取り除かれると、残りの荷電亜原子粒子は陽子だけになります。したがって、H イオンは陽子に似ています。
プロトン化の例を以下に示します:
<オール>NH3 + H → NH4
- 水のプロトン化により、ヒドロニウム イオンが生成されます
H2 O + H ↔ H3 O

図 1:水分子のプロトン化
- アルコールのプロトン化
C2 H5 ああ + H → C2 H5 OH2
脱プロトンとは
脱プロトン化とは、酸塩基反応中にブレンステッド・ローリー酸からプロトンを除去することです。 (ブレンステッド・ローリー酸は、プロトンを放出して共役塩基を形成できる化合物です)。プロトンは +1 電荷を帯びており、プロトンの除去は +1 電荷の除去に等しいため、これは化学種の全体的な電荷に直接影響します。脱プロトン化により、化学種の共役塩基が得られます。
水分子は、プロトンを供与または受容できる両性化合物です。したがって、プロトン化と脱プロトン化の両方の反応を受けます。水分子の脱プロトン化により、水酸化物アニオン (OH) が生成されます。
H2 O ↔ H + OH
有機化学では、さまざまな合成経路で脱プロトンが非常に重要です。たとえば、NaNH2 などの塩基によるアルキンの脱プロトン化 脱プロトン化によりアルキンのナトリウム塩を与える 。これは、アルキンの末端水素が非常に酸性であり、容易に除去されるために起こります。次に、この塩に別の有機化合物を結合させることができます。
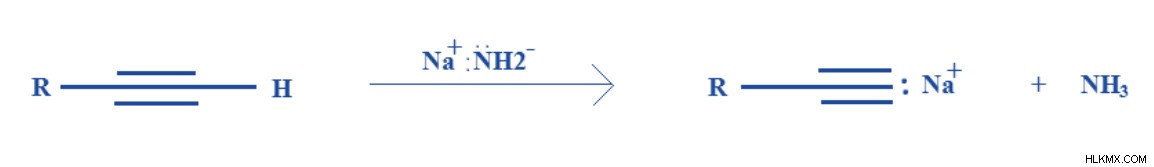
図 2:アセチレンと NaNH2 の反応
(C2 H2 + NaNH2 → HC2 ナ + NH3 )
プロトン化と脱プロトン化の違い
定義
陽子化: プロトン化は、原子、分子、またはイオンへのプロトンの付加です。
脱プロトン: 脱プロトン化とは、酸塩基反応中にブレンステッド・ローリー酸からプロトンを除去することです。
陽子移動
陽子化: プロトン化は化合物にプロトンを追加します。
脱プロトン: 脱プロトン化は、化合物からプロトンを取り除きます。
電荷の変化
陽子化: プロトン化は化合物に +1 電荷を追加します。
脱プロトン: 脱プロトン化により、化合物から +1 電荷が除去されます。
結論
プロトン化と脱プロトン化は、2 つの基本的な化学反応です。プロトン化と脱プロトン化の主な違いは、プロトン化が化合物に +1 電荷を追加するのに対し、脱プロトン化は化合物から +1 電荷を除去することです。
参照:
1.ヘルメンスティン、アン・マリー。 「プロトン化の定義と例」 ThoughtCo、2017 年 2 月 11 日、こちらから入手可能。
2.「アルコール プロトン化:過剰な反応のための合成中間体」 Quirky Science、2018 年 1 月 23 日、こちらから入手可能。
3.「アルキン:脱プロトン化と SN2」。マスター有機化学 RSS、こちらから入手できます。
画像提供:
1. Esmu Igors による「アルコール プロトン化」 – Commons Wikimedia による自身の作品 (CC BY-SA 3.0)