主な違い - S 軌道と P 軌道
原子は、原子核の周りを任意の方向に連続的に移動する電子で構成されています。それらは原子核の周りを動いているため、特定の瞬間におけるその電子の正確な位置を決定することはできません.電子がある位置にある確率を推測することしかできません。この現象はハイゼンベルグの不確定性原理と呼ばれます .これらの確率によると、電子が最も高い確率で見つかる領域は、軌道という用語で説明されます。原子核の周りの電子のエネルギーと動きに応じて、さまざまな軌道が存在する可能性があります。 S軌道とp軌道は、そのような2つの軌道です。 s 軌道と p 軌道の主な違いは、s 軌道は球形であるのに対し、p 軌道はダンベル形であることです。
対象となる主な分野
1. S軌道とは
– 定義、形状、構造特性
2. P軌道とは
– 定義、形状、構造特性
3. S軌道とP軌道の類似点は何ですか
– 共通機能の概要
4. S軌道とP軌道の違いは何ですか
– 主な相違点の比較
重要な用語:原子、ハイゼンベルグの不確定性原理、軌道、P 軌道、確率、S 軌道 
S 軌道とは
S 軌道は球形の原子軌道です。他の原子軌道と比較すると、エネルギーが最も低いです。各電子殻には、少なくとも 1 つの s 軌道があります。 S軌道は、他の軌道の中で最も単純な原子軌道です。 1 つの s 軌道は、最大 2 つの電子を保持できます。 S軌道には部分軌道がありません。文字「s」は「シャープ」を表します。この軌道は、その軌道内の電子の角運動量を考慮して名付けられました。原子軌道は一定のエネルギー準位で構成されている (エネルギーは量子化されている) ため、量子数が与えられます。 S 軌道は、原子の角運動量量子数を割り当てます。
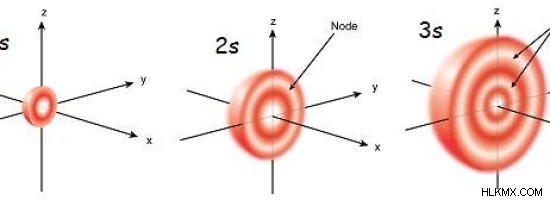
図 1:s 軌道のサイズは、主量子数の増加に伴って増加します
s 軌道の 2 つの電子は反対のスピンを持っています。 S軌道は化学結合に関与しています。それらはシグマ結合の形成に参加できます。しかし、これらの s 軌道は pi 結合を形成できません。球形は、電子が見つかる可能性が最も高い領域を示しています。 S軌道には角度ノードがありません。したがって、s 軌道の角運動量量子数は 0 です。
S 軌道は、同じ電子殻にある他のすべての軌道の中で最もエネルギーが低い軌道です。より高い電子殻 (主量子数 =n) では、s 軌道は最も近い下部殻 (n-1) の d 軌道よりもエネルギーが低くなります。 s 軌道球のサイズは、主量子数の増加とともに増加します。
P 軌道とは
P 軌道はダンベル型の原子軌道です。 P 軌道は s 軌道よりも高いエネルギーを持っています。文字「p」は「プリンシパル」を表します。これは、p 軌道の電子の角運動量を表します。 1 つの p 軌道は、最大 6 個の電子を保持できます。これらの電子は、亜原子軌道を占有します。 1 つの亜原子軌道は、最大 2 つの電子しか保持できません。したがって、1 つの p 軌道には 3 つの亜原子軌道があります。それらは、px、py、および pz と名付けられています。一般に、これらはすべて p 軌道と呼ばれます。
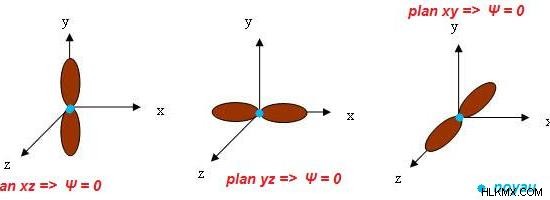
図 2:3 つの P 軌道の形状と方向
p 軌道の 3 つの副軌道は、原子内のこれらの軌道の向きによって互いに異なります。ただし、形状は似ています。これらの準軌道はすべてダンベル型です。 p 軌道に関する特別な特徴の 1 つは、それが角度のあるノードで構成されていることです。したがって、p 軌道の角運動量量子数は 1 です。
主量子数 1 を持つ電子殻を除いて、他のすべての電子殻は p 軌道で構成されています。 p軌道のサイズは、主量子数の増加とともに増加します。 1 つの p 軌道には 2 つのローブがあります。これらのローブは、軸に沿って対称です。これらのp軌道は化学結合に関与しています。それらは、シグマ結合またはパイ結合のいずれかを形成できます。水平方向の P サブ軌道は、シグマ結合に使用できます。他の 2 つの準軌道は、パイ結合に関係しています。
S 軌道と P 軌道の類似点
- S 軌道と P 軌道は原子軌道の一種です。
- どちらの用語も、その軌道における電子の角運動量を表しています。
- 両方の軌道がシグマ結合に関与しています。
S 軌道と P 軌道の違い
定義
S軌道: S 軌道は、球状の原子軌道です。
P軌道: P 軌道はダンベル型の原子軌道です。
エネルギーレベル
S軌道: S 軌道はエネルギー準位が最も低くなります。
P軌道: P 軌道は s 軌道よりも高いエネルギーを持っています。
Angular ノード
S軌道: s 軌道には角度ノードがありません。
P軌道: p軌道には角節があります
最大電子数
S軌道: s 軌道が保持できる電子の最大数は 2 です。
P軌道: p 軌道が保持できる電子の最大数は 6 です。
部分軌道
S軌道: s 軌道には部分軌道はありません。
P軌道: p 軌道には 3 つのサブ軌道があります。
角運動量量子数
S軌道: s 軌道の角運動量量子数は 0 です。
P軌道: p 軌道の角運動量量子数は 1 です。
ローブ
S軌道: s 軌道にはローブはありません。
P軌道: p 軌道にはローブがあります。
結論
s 軌道も p 軌道も原子軌道です。これらの軌道は、その原子の電子を見つけることができる最も可能性の高い領域を示しています。 s 軌道と p 軌道の主な違いは、s 軌道が球形であるのに対し、p 軌道はダンベル型であることです。







