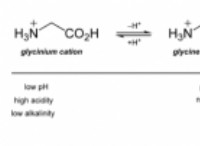
アンモニアが水に溶けるときに発生する反応は次のとおりです。
nh3 + h2o⇌nh4 + + oh-
この反応では、アンモニア分子は水と反応してアンモニウムイオンNH4+および水酸化物イオンOH-を形成します。溶液中に水酸化物イオンが存在すると、そのpHが増加し、より基本的になります。
室温でpHが10の溶液の場合、水酸化物イオンの濃度[OH-]は、次の式を使用して計算できます。
[oh-] =10^( - ph)=10^( - 10)m =1 x 10^-10 m
したがって、pHが10のアンモニア溶液では、水酸化物イオン(OH-)が溶液の基本的な性質と高いpHに関与しています。