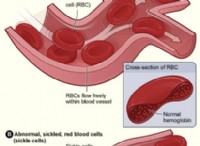
反応のバランスの取れた化学式は次のとおりです。
$$ n_2 + 3h_2 \ rightArrow 2nh_3 $$
方程式によれば、1モルの窒素は3モルの水素と反応します。したがって、0.1 molの水素は、完全な反応を達成するために1/3モルの窒素を必要とします。
理想的なガス法を使用すると、$$ pv =nrt $$で、pは圧力、vは体積、nはモル数、rは理想的なガス定数、tは温度です。
方程式を再配置して窒素の体積を計算できます:$$ v =\ frac {nrt} {p} $$
与えられた:
- 温度、$$ t =215°C + 273 =488 k $$(摂氏をケルビンに変換)
- 圧力、$$ P =715 mmHg =715/760 =0.941 ATM(MMHGをATMに変換)$$
- 窒素のモル数、$$ n =\ frac {1} {3} \ times 0.1 =0.033 mol $$
- ガス定数、$$ r =0.08206 L * atm / mol * k $$
値のプラグ:$$ v =\ frac {(0.033 mol)\ times(0.08206 l * atm / mol * k)\ Times(488 k)} {0.941 atm} $$ $$ v \約1.14 l $$ v \
したがって、215°Cと715mmHgで約1.14リットルの窒素が、0.1 molの水素と反応し、アンモニアを産生するために必要です。