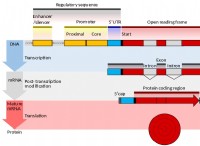
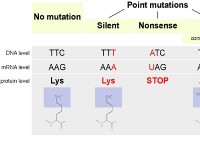
これが故障です:
* 電気陰性度: これは、化学結合で電子を自分自身に引き付ける原子の能力の尺度です。
* 電気陰性度の違い: 2つの結合原子間で電気陰性度に有意な差がある場合、より多くの電気陰性原子は共有電子をそれ自体に近づけます。これにより、より多くの電気陰性原子に部分的な負電荷(Δ-)が生成され、より少ない電気陰性原子に部分的な正電荷(Δ+)が生成されます。
* ポーラー結合: 電子のこの不平等な共有は、極結合につながります 、結合の一方の端はわずかに負で、もう一方の端はわずかに正です。
例:
*水素(H₂)の水素(H)と酸素(O)の結合は極性結合です。酸素は水素よりも電気陰性であるため、共有電子をそれ自体に近づけ、酸素原子をわずかに陰性にし、水素原子をわずかに陽性にします。
重要な注意:
*結合中の極性の程度は、原子間の電気陰性度の違いによって決定されます。違いが大きいほど、結合は極性になります。
*結合は非極性と見なされます 原子間の電気陰性度の差が非常に小さいまたはゼロの場合。これは通常、2つの原子が同じ要素である場合に発生します。
より多くの例が欲しいか、特定の債券について話し合いたいかどうかを教えてください!