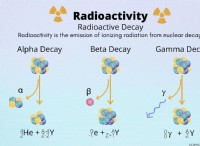
その理由は次のとおりです。
* 「塩」は広い用語です: 通常、酸と塩基の反応によって形成されるイオン化合物を指します。
* 溶解度は多くの要因に依存します: これらには、関与する特定のイオン、温度、および溶液中の他の物質の存在が含まれます。
ただし、いくつかの一般化を作成できます:
* グループ1(アルカリ金属)およびグループ2(アルカリアースメタル)塩は、一般に他のグループの塩よりも溶けやすいです。 これは、カチオン(正に帯電したイオン)が小さく、電荷が低いため、水分子と相互作用する可能性が高いためです。
* グループを下ると溶解度が低下します。 これは、陽イオンがより大きくなり、水分子に惹かれるためです。
* 特定の金属の塩の溶解度は大きく異なる可能性があります。 たとえば、塩化ナトリウム(NaCl)は非常に溶けやすいですが、塩化銀(AGCL)は実質的に不溶です。
溶解度の傾向を理解するには、関係するイオンの特定の化学的特性を考慮する必要があります。
要約: 溶解度には一般的な傾向がありますが、普遍的に最も溶けやすい塩要素の単一のグループはありません。