コア コンセプト
この化学のチュートリアルでは、バッファについて紹介します 緩衝液の定義と、酸性緩衝液と塩基性緩衝液の成分を学ぶことによって また、添加した酸や塩基とどのように反応するか。さらに、さまざまな潜在的なバッファーの例を学習します。最後に、ヘンダーソン・ハッセルバルヒ方程式に触れます。調べてみましょう、緩衝液とは何ですか?
他の記事で取り上げるトピック
- 酸塩基化学
- 酸と塩基の性質
- ルイス酸と塩基の定義
- 強酸と強塩基
- 酸塩基理論
- 共通イオン効果
緩衝液の定義
化学における緩衝液の定義 酸または塩基の添加による pH 変化に抵抗できる溶液です。弱酸とその共役塩基、またはその逆の溶液で構成されています。
緩衝液は、酸塩基化学で使用される非常に有用な溶液です。溶液が強酸または強塩基と混ざると、pH が急速かつ劇的に変化することがあります。緩衝液は、追加された酸または塩基の一部を中和するのに役立ち、pH がより緩やかに変化できるようにします。これは、水素または水酸化物イオンと反応する成分で構成されているため、最大容量で pH に影響を与えることができません。
緩衝液には、中和できる量に制限があります。このバッファーが容量に達すると、溶液はバッファーが存在しないかのように機能し、pH が再び劇的に変化し始める可能性があります。
強酸と強塩基の分析と実験は、バッファーを使用することで簡単になります。血液の pH を調節するために使用されるバイオカーボネート緩衝システムは、実際の緩衝液の使用例です。
緩衝液の成分
バッファーには、弱酸とその共役塩基または弱塩基とその共役酸の 2 つの選択肢のいずれかが含まれている必要があります。成分の選択方法は、溶液の望ましい pH と関係があります。
酸性緩衝液
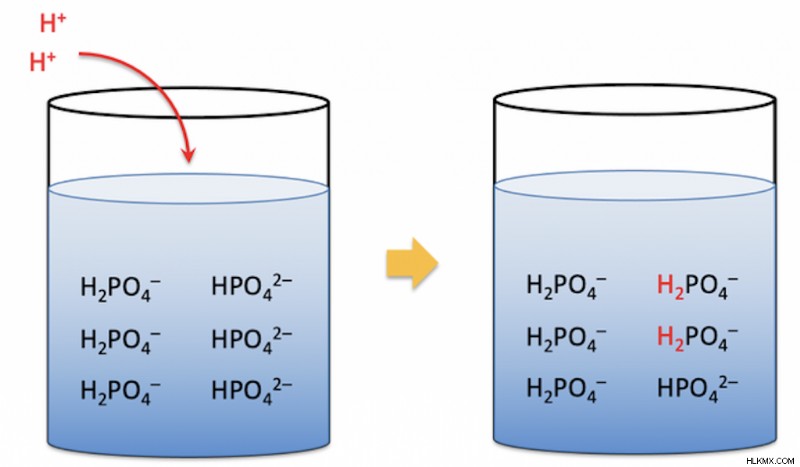
酸性緩衝液の pH は 7 未満です。これらの溶液は、弱酸とその共役塩基を塩として使用して作られています。溶液の pH を変更したい場合は、酸と塩の比率を変更できます。さらに、さまざまな酸が (共役塩とともに) さまざまな方法で pH に影響を与える可能性があります。
酢酸と酢酸ナトリウムは、弱酸とその共役塩の例です。酸平衡は左に向かっています。ただし、酢酸ナトリウムを追加すると、酢酸イオンが溶液に追加されます。ルシャトリエの原理により、平衡は左に切り替わります。
CH3 COOH(aq) ⇄ CH3COO(aq) + H(aq)
酸性緩衝液への酸の添加
上記のバッファーの例を念頭に置いて、酸が追加されるとどうなるでしょうか?バッファーは、入ってくる酸から水素イオンを除去するために機能する必要があります。酢酸イオンはこれらの水素イオンと結合して酢酸を生成します。酢酸は弱酸であるため、酢酸が再び解離するよりも速く水素イオンを除去することができます。これが、pH が劇的に変化しない理由です。
酸性緩衝液への塩基の添加
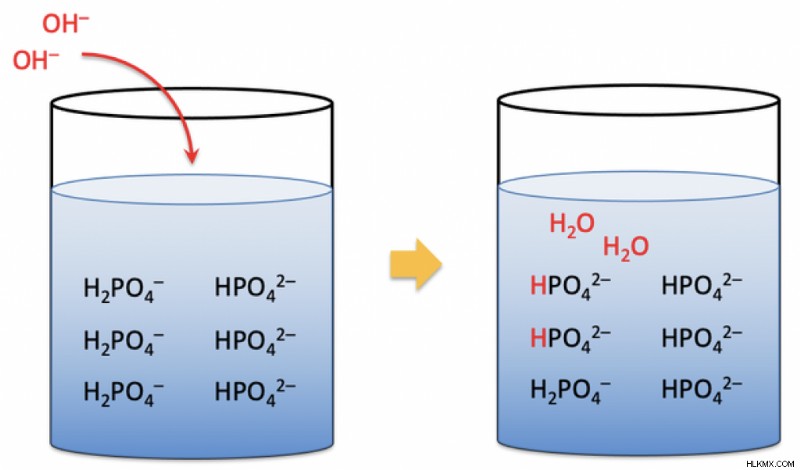
繰り返しますが、上からの緩衝液を覚えておきましょう。このバッファーと対話するための base の追加は、もう少し複雑です。酢酸は塩基からの水酸化物イオンと相互作用し、水と一緒に酢酸イオンを形成します。水酸化物イオンはこれから除去されるため、pH の上昇を引き起こしません。さらに、酢酸の解離による余分な水素イオンも水酸化物と結合して水を形成する可能性があります。これらの方法では、ほとんどの水酸化物イオンが水素イオンと相互作用して塩基性物質を除去しますが、pH を大幅に変化させるには十分ではありません.
塩基性 (アルカリ性) バッファー
塩基性緩衝液の pH は 7 を超えています。これらの溶液は、弱塩基とその共役酸から作られています。両方のコンポーネントの濃度は開始時に等しくなければなりません。ただし、酸性緩衝液と同様に、塩基と酸性塩の比率を変えることで溶液の pH を変えることができます。
アンモニアと塩化アンモニウムは、共役酸を含む弱塩基の例です。均衡は左に向かっています。ただし、塩化アンモニウムを追加すると、アンモニウム イオンが溶液に追加されます。今回は、ル・シャトリエの原理が均衡をさらに左に移動させます。
NH3(aq) + H2 O(l ) ⇄ NH4 (aq) + OH(aq)
塩基性緩衝液への酸の添加
上記のバッファの例を念頭に置いて、酸が追加された場合に何が起こるかを分析しましょう.追加された酸からの水素は、アンモニアと相互作用してアンモニウムイオンを形成します。これにより、多くの水素イオンが除去されます。さらに、アンモニアと水の間の反応により、溶液中に水酸化物イオンがいくらか存在します。これらの水酸化物イオンは酸性水素と相互作用して、より多くの水を形成します。これらの方法により、ほとんどの水素イオンが除去されて酸性の存在が除去され、pH 変化の緩衝に役立ちます。
基本バッファーへのベースの追加
緩衝液に上から塩基を加えたらどうなりますか?バッファーは、入ってくる塩基から水酸化物イオンを除去するために機能する必要があります。溶液中のアンモニウムイオンは水酸化物イオンと反応します。アンモニアは弱塩基であるため、水と反応すると反応が逆になる可能性がありますが、すべての水酸化物イオンが溶液から除去されるわけではありません。これにより、pH が劇的に変化することはありません。
緩衝液の例
- 酢酸と共役塩基:CH3 COOH &CH3 COO
- ギ酸と共役塩基:HCHO2 &CHO2
- ピリジン &共役酸:C5 H5 N &C5 H5 ひ
- アンモニアと共役酸:NH3 &NH4
- メチルアミン &共役酸:CH3 NH2 &CH3 NH3
ヘンダーソン ハッセルバルヒの式
弱酸とその共役塩基を使用してバッファーを作成すると、バッファーの pH が維持され、少量の酸または塩基が追加された場合にその pH の変化に耐えることができます。 ヘンダーソン ハッセルバルヒの方程式 は、弱酸の pKa を使用してバッファーの pH を計算します。この方程式を使用した詳細な例については、別の記事で説明します。
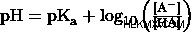
さらに読む
- 化学反応を簡単に
- 混合対。化合物
- ル・シャトリエの原則
- レドックス反応を理解する







