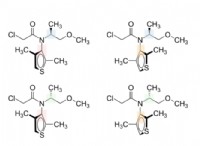
酸化還元滴定の背後にある化学
酸化還元滴定は、未知の溶液の濃度を決定するために滴定剤と分析物の間の電子の伝達を利用する強力な分析手法です。主要な化学概念の内訳は次のとおりです。
1。酸化還元(酸化還元)反応:
* 酸化: 種による電子の喪失。
* 削減: 種による電子の増加。
* 酸化還元カップル: 電子の獲得または損失によって相互変換可能な化学種のペア。
* 酸化還元反応: 2つの種間の電子の伝達を含む反応。
2。滴定原則:
* 滴定: 分析物との反応に使用される既知の濃度の溶液。
* 分析物: 分析されている未知の濃度の物質。
* 等価ポイント: 滴定剤のほくろが添加されている滴定の点は、存在する分析物のほくろと化学的に同等です。
* エンドポイント: 視覚インジケーターが反応の完了を指示する滴定のポイント。
3。酸化還元滴定メカニズム:
*滴定剤には、レドックス反応で分析物と反応する酸化還元活性種が含まれています。
*反応は、すべての分析物が消費されるまで進行し、その結果、溶液の可能性が変化します。
*このポテンシャルの変化は、色の変化、導電率の変化、またはpHの変化になる可能性のあるインジケータを使用して監視されます。
4。標準電極電位(E°):
*種が電子を獲得する傾向の尺度(減少)。
*レドックス反応の実現可能性と方向を予測するために使用されます。
5。 Nernst方程式:
*電極電位、標準電極電位、および反応種の濃度との関係について説明します。
*滴定中に異なるポイントで溶液の可能性を計算することができます。
6。重要な考慮事項:
* 滴定の選択: 滴定剤は、分析物と迅速かつ化学的に反応する強力な酸化または還元剤である必要があります。
* インジケータ選択: インジケータは、等価ポイントの近くで色を変える適切な酸化還元カップルである必要があります。
* 環境条件: 温度やpHなどの要因は、反応速度と溶液の可能性に影響を与える可能性があります。
酸化還元滴定の例:
* 過マンガン酸滴定: 強力な酸化剤として過マンガン酸カリウム(Kmno4)を使用して、鉄(II)イオンのような還元剤の濃度を決定します。
* ヨウ素 - チオ硫酸塩滴定: ビタミンCのような還元剤の濃度を決定するために、ヨウ素(I2)を滴定剤として使用する
酸化還元滴定の利点:
*高精度と精度。
*幅広い分析物に適用可能な汎用性のある手法。
*比較的安価で実行が簡単です。
酸化還元滴定は、サンプルを分析し、重要な成分の濃度を決定するために、化学、環境監視、品質管理など、さまざまな分野で使用される基本的な手法です。