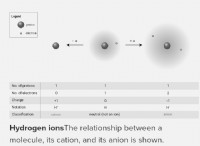
電気陰性度:
*電気陰性度は、分子内の原子が電子をそれ自体に引き付ける能力です。それは相対的な尺度であり、他の原子と比較していることを意味します。
*より高い電気陰性度とは、電子のより強い引っ張りを意味します。
*電気陰性の差(ΔEN)は、より電気陰性原子からの電気陰性原子の電気陰性度を減算することによって計算されます。
電気陰性度の違いに基づく結合タイプ:
1。イオン結合(Δen> 1.7):
*大きな電気陰性度の違いは、1つの原子による電子の有意な引っ張りを示します。
*これにより、一方の原子が本質的に他の原子から電子を盗み、イオンを形成します(正に帯電したカチオンと負に帯電した陰イオン)。
*これらのイオンは静電力によって結合され、強いイオン結合を形成します。
*例:NaCl(塩化ナトリウム)。ここで、ナトリウム(NA)の電気陰性度が低く、塩素(CL)は電気陰性度が高い。
2。共有結合(Δen<1.7):
*電気陰性度の違いは、電子のよりバランスの取れた共有を示します。
*両方の原子は、安定した電子構成を実現するために電子を共有することにより結合に寄与します。
*電気陰性の違いに基づいて、共有結合の2つのサブタイプがあります。
* 非極性共有結合(Δen≈0): 電子は原子間で等しく共有されます。
* 極性共有結合(0 <Δen<1.7): 電子は不均等に共有され、より多くの電気陰性原子が共有電子にわずかに強い引っ張りを持ち、一方の原子に部分的な正電荷(Δ+)、他の原子に部分的な負電荷(Δ-)が生成されます。
キーポイント:
*電気陰性度の違いはガイドラインであり、厳格なルールではありません。一部の結合は、イオンと共有結合の間の「灰色の領域」に落ちる可能性があります。
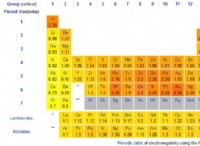
*電気陰性度値は、ポーリングスケールやムリケンスケールなどの特定のスケールに基づいています。
*電気陰性度の違いを理解することで、結合の種類、分子の極性、および物質の特性を予測することができます。
例:
* H-Cl(塩化水素): H =2.1、Cl =3.0の電気陰性度。 Δen=0.9。これは、塩素が部分的な負電荷を有し、水素が部分的な正電荷を有する極性結合結合を示しています。
* na-cl(塩化ナトリウム): Na =0.9の電気陰性度、Cl =3.0。 Δen=2.1。これはイオン結合を示しており、ナトリウムは電子を失い、陽性イオン(Na+)になり、塩素が電子を獲得して負イオン(Cl-)になります。
要約すると、電気陰性の違いは、化学結合の性質と分子の挙動を理解するための強力なツールです。