Beer-Lambert の法則によると、サンプルによって吸収される光の量は、光が通過するサンプルの体積とサンプルの濃度に直接関係します。ベールの法則とも呼ばれます。
Beer-Lambert の法則とは
Beer-Lambert の法則は、サンプルの濃度を、サンプルがサンプルを通過するときにサンプルが吸収する光の量に関連付けます。 Beer-Lambert の法則の式は、一般に次のように記述されます。
A=εLc
A=吸光度
ϵ =モル吸光係数
L =パスの長さ
C =サンプルの濃度
吸光度は、サンプルに入る光とサンプルから出る光の強度の比率に関連しています。
A =ログ 10 (私0 /I)
私0 =サンプル前の光の入射光強度
I =透過光 – サンプル後の光の強度
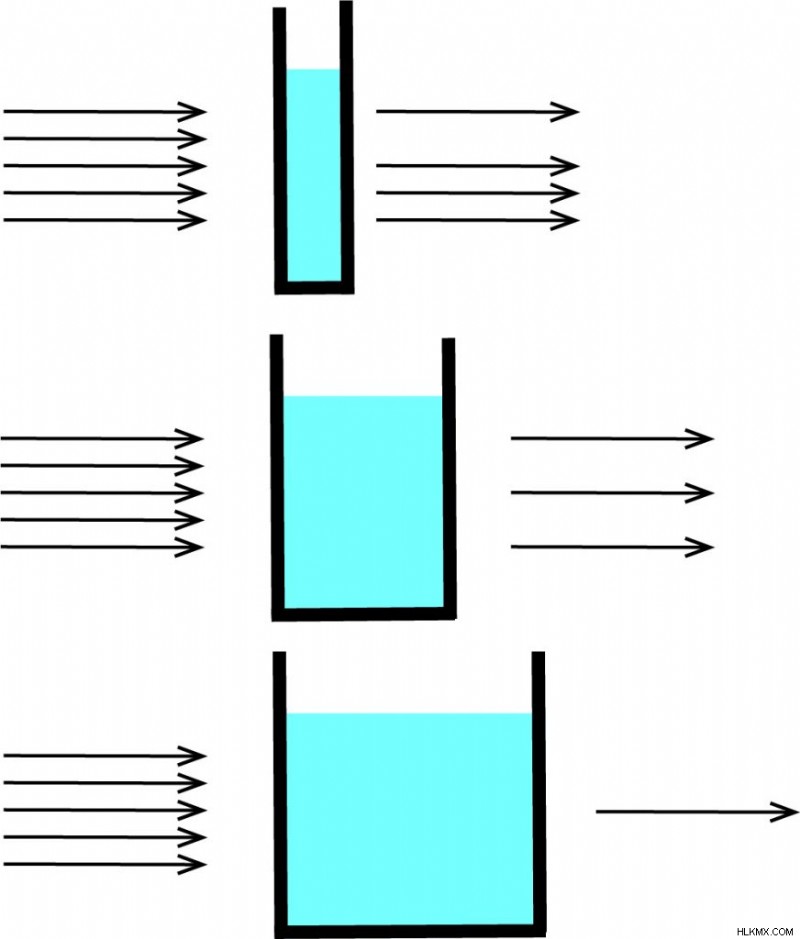
Beer-Lambert の法則は、サンプルの吸収および透過測定で一般的に使用され、サンプルの濃度を決定するために使用できます。吸収測定では、光はサンプルで満たされたキュベットを通過します。キュベット通過後の光の強度を、キュベット通過前の光と比較します。キュベットのサイズによって光路長 (L) が決まります。 (キュベットは特殊なガラス製品です。) キュベットの幅が広いほど、光が通過するサンプルが多くなり、透過光は低くなります。これは、方程式がパスの長さ (L) に依存する理由を説明しています。
モル吸光係数とは?
モル吸光係数はすべての化学物質に固有であり、Beer-Lambert の法則の重要な変数です。モル吸光係数は、物質が吸収する光の量を測定し、波長によって異なります。また、モル吸光係数またはモル吸光率と呼ばれることもあります。方程式では、ほとんどの場合、イプシロン ϵ として記号化されます。
モル吸光係数の単位は、最も一般的には Mcm です。単位は、光路長とサンプル濃度の単位と一致する必要があります。そうすれば、吸光度は単位のない数値になります。グラフでは、吸光度は多くの場合、任意の単位を表す A.U. の単位で書かれています。
Beer-Lambert の法則グラフ
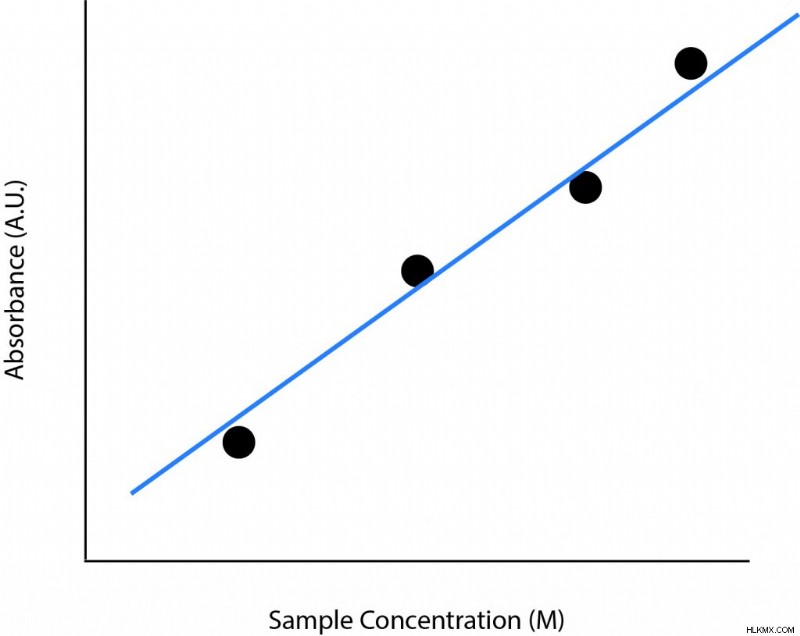
Beer-Lambert の法則を示す典型的なグラフは線形で、正の相関があります。 X 軸は濃度の単位を持ち、Y 軸は吸光度になります。これは、式の他の 2 つの変数、モル吸光係数と光路長が一定に保たれていることを示しています。濃度が上がると吸光度も上がります。濃度が増加すると、光を吸収する分子が増えて吸収が増加するため、このパターンは理にかなっています。
以下は、Beer-Lambert の法則を示すものに似たグラフです。いくつかの異なる濃度が測定されます。次に、これらの点に線を当てはめます。線の傾きは、経路長にモル吸光係数を掛けたものになります。光路長が分かれば、モル吸光係数は簡単に求めることができます。モル吸光係数は、線の傾きを経路の長さで割ったものになります。
Beer-Lambert の法則の適用
Beer-Lambert の法則は、ヨウ素時計反応などの実験にとって重要な未知の濃度のサンプルの濃度を決定するために一般的に使用されます。これを行うには、既知の濃度の複数のサンプルの最初の吸光度を測定します。分光計がこの測定を行います。これらの点は線に適合します。この線は、モル吸光係数×経路長の傾きになります。これを光路長で割ると、モル吸光係数が得られます。その後、未知のサンプルの吸収を測定できます。吸収を光路長で割ってモル吸光係数を掛けると、サンプルの濃度が得られます。
法律の制限
この法則は、高濃度では不正確になる傾向があります。これは、さまざまな要因の組み合わせによるものです。溶液の屈折率がずれることがあります。目的の分子が互いに相互作用することにより、飽和および凝集効果が生じる可能性があります (低濃度での状況のように溶媒だけではありません)。 Beer-Lambert の法則の限界をテストする優れた方法は、サンプルの濃度が高くなるにつれて、濃度対吸収のプロットを作成することです。プロットは線形になるはずですが、高濃度では線形ではなくなります。この時点で、濃度が高いと法則が不正確になります。
Beer-Lambert の法則の限界をテストする優れた方法は、サンプルの濃度が高くなるにつれて、濃度対吸収のプロットを作成することです。プロットは線形になるはずですが、高濃度では線形ではなくなります。この時点で、濃度が高いと法則が不正確になります。
問題例
問題例 #1 :未知の濃度のローダミン色素の溶液があります。分光計を使用して吸収を測定すると、9048 となります。 ローダミンのモル吸光係数は 116000 cm M です。使用したキュベットの光路長は 1 cm です。サンプルの濃度は?
解決策の例 #2: ここでは、Beer-Lambert の法則における C の値を決定しようとしています。そこで、探している変数を解くために方程式を再配置することから始めます
A =ϵLc
c =A / ϵL
次に、値のプラグインを開始できます。濃度がモル濃度の単位で表されるように、単位に注意してください。
c =9048 / (1 cm * 116000 cm M)
c =9048 / 116000 M
0.078 M =c
未知の溶液の濃度は 0.078 M です。







