1。エネルギーレベル:
*原子はエネルギーレベルを量子化しています。つまり、電子は離散エネルギー値でのみ存在できます。これらのレベルは、多くの場合、基底状態(最低エネルギー)および励起状態(より高いエネルギー)に対応する1、2、3などのような数字で表されます。
2。電子構成:
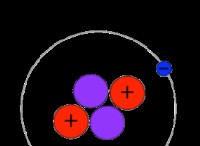
*原子の原子状態は、これらのエネルギーレベルの中でその電子の分布によって決定されます。たとえば、その基底状態の水素原子は、最も低いエネルギーレベル(n =1)で単一電子を持っていますが、励起状態では、電子がより高いレベル(n =2、3など)である可能性があります。
3。確率:
* Quantum Mechanicsは、特定の時間に電子の正確な位置を知ることができないことを指示しています。代わりに、波動関数を使用して、空間の特定の領域で電子を見つける確率を説明します。原子状態には、原子内の各電子のこれらの確率が組み込まれています。
4。表記:
*原子状態は、主要な量子数(n)、角運動量量子数(L)、および各電子のスピン量子数を含む分光表記を使用してしばしば表されます。たとえば、水素の基底状態は1S1として表され、その単一電子がn =1、l =0、およびs =1/2状態にあることを示しています。
5。遷移:
*原子は、光の光子を吸収または放出することにより、異なる原子状態間で移行できます。これらの遷移は、どのエネルギーレベルの変化が許可されるかを決定する特定の選択ルールに従います。
キーポイント:
*原子状態は量子化されています。つまり、特定の状態のみが可能です。
*原子状態は、原子のエネルギー、化学的性質、および光との相互作用を決定します。
*分光法、レーザー技術、量子化学などの分野では、原子状態を理解することが重要です。
簡単に言えば、原子状態は、原子の内部エネルギー構成と電子分布のスナップショットのようなものです。これは、原子のエネルギーレベル、電子構成、および異なる場所でその電子を見つける可能性を説明する方法です。