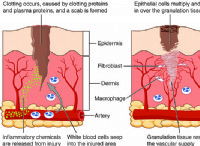
1。 原子と電荷:
* 陽子: 原子の核に位置する陽子は正電荷を持ちます。
* 電子: 核を周回すると、電子は負電荷を運びます。
* 中性子: また、核では、中性子には電荷がありません(それらは中性です)。
2。価電子の重要性:
* 価電子: これらは原子の最も外側の電子であり、化学結合に関与するものです。
* オクテットルール: 多くの原子は、8つの原子価電子(非常に安定した貴族のような8つの価電子を持つように努力しています。
3。化学結合:
* イオン結合: 原子が安定した電子構成を実現するために電子を獲得または失うと、それはイオンになります。 原子が電子を失うと正のイオン(陽イオン)が形成されます。原子が電子を獲得すると、負のイオン(アニオン)が形成されます。
* 共有結合: 原子は電子を共有して、安定した構成を実現します。
4。中立性の達成:
* イオン化合物: 反対に充電されたイオン結合がある場合、彼らの請求は互いにキャンセルします。 たとえば、NaCl(テーブル塩)は、正に帯電したナトリウムイオン(Na+)と負に帯電した塩化物イオン(Cl-)から形成されます。化合物の全体的な電荷はゼロであり、電気的にニュートラルになります。
* 共有化合物: 電子を共有することにより、原子は安定した構成を実現し、電荷のバランスを効果的にバランスさせます。たとえば、水(H2O)では、各水素原子は酸素原子と電子を共有します。この共有は、中性分子を作成します。
要約:
*化合物は、正と負の電荷のバランスをとる方法で構成原子を配置することにより、電気中立性を実現します。
*このバランスは、イオン結合(反対に帯電したイオンが引き付ける)または共有結合(電子が共有される場合)によって達成されます。
*結果は、ネット中立電荷を備えた安定した化合物です。