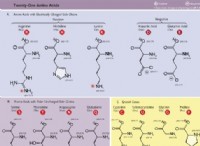
共鳴構造が必要な理由の内訳は次のとおりです。
* ルイス構造の制限: ルイス構造は、結合を描写する単純化された方法ですが、分子内の電子の真の分布をキャプチャできない場合があります。 単一のルイス構造は、分子で観察される実際の結合長と結合順序を正確に表すことができない場合があります。
* 電子非局在化: 二重結合または三重結合を持つ分子では、それらの結合の電子は、関与する2つの原子のみに限定されません。代わりに、それらは複数の原子にわたって非局在化することができます。この非局在化は、より安定した低エネルギーの配置につながります。
* 共鳴ハイブリッド: 共鳴構造は、非局在電子の可能な位置を描写する異なるルイス構造です。実際の分子はこれらの構造のいずれかではなく、共鳴ハイブリッド 、これは、寄与構造の加重平均です。このハイブリッド構造は、電子の非局在化を反映し、分子の結合のより正確な表現を提供します。
共鳴構造で最もよく表される分子の例:
* ベンゼン: ベンゼンには、交互の単一結合と二重結合を備えたリングに6つの炭素原子があります。単一のルイス構造では、ベンゼンで観察された等しい結合長を完全にキャプチャできません。代わりに、2つの共鳴構造が使用され、リング内の異なる位置の間にシフトする二重結合が示されています。実際の構造は、これら2つの構造のハイブリッドであり、非局在化電子がリング全体に分布しています。
* 硝酸イオン(NO3-) :硝酸イオンには、単一のルイス構造で正確に表現することはできない3つの同等の窒素酸素結合があります。共鳴構造は、各酸素原子間の二重結合シフトを示しています。
要約すると、単一のルイス構造が分子内の電子の非局在化を適切に描写できない場合、共鳴構造が必要です。これらの構造の組み合わせである共振ハイブリッドは、分子の実際の結合のより正確な表現を提供します。