* 高イオン化エネルギー: イオン化エネルギーは、原子から電子を除去するのに必要なエネルギーです。これらの元素は比較的高いイオン化エネルギーを持っているため、原子から電子を除去するにはかなりの量のエネルギーが必要です。これにより、電子を失い、陽イオンを形成することはエネルギー的に好ましくありません。
* 高い電気陰性度: 電気陰性度は、電子を引き付ける原子の傾向を測定します。ホウ素、炭素、およびシリコンは比較的高いエレクトロニガティビティを持っているため、電子を失うのではなく、電子を引き付ける可能性が高くなります。これはさらに、単純な陽イオンの形成を思いとどまらせます。
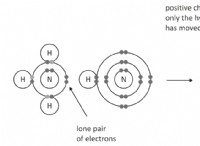
単純なイオンを形成する代わりに、これらの元素は共有結合を形成することにより、安定した電子構成を実現する傾向があります 。それらは他の原子と電子を共有し、分子またはネットワーク構造を形成します。
各要素のより詳細な説明は次のとおりです。
* ボロン: ホウ素には3つの価電子しかありません。安定したオクテットを達成するには、これらの3つの電子を失う必要があり、非常に高いイオン化エネルギーを必要とします。代わりに、ホウ素は、トリフッ化ホウ素(BF₃)に見られるように、しばしば他の3つの原子を備えた共有結合を形成します。
* 炭素: 炭素には4つの価電子があります。メタン(Ch₄)に見られるように、4つの共有結合を形成することにより安定性を達成できます。単純なイオンを形成するには、4つの電子を獲得する(電気陰性度のために非常にありそうもない)または4つの電子(イオン化エネルギーが高すぎる)のいずれかを必要とします。
* シリコン: 炭素と同様に、シリコンには4つの価電子があり、他の元素と共有結合を形成します。砂の主要成分である二酸化シリコン(SIO₂)のように、長いチェーンと複雑な構造を形成できます。
要約すると、ホウ素、炭素、シリコンの高いイオン化エネルギーと電気陰性度により、単純なイオンを形成することはエネルギー的に好ましくありません。彼らは共有結合を形成し、他の原子と電子を共有して安定性を達成することを好みます。