座標結合は、座標を持つオブジェクトまたはフィーチャ間に形成される結合です。座標は、2D または 3D 空間内のオブジェクトまたはフィーチャの位置を示す一連の数値によって指定されます。オブジェクトまたはフィーチャの座標は、座標平面またはグリッド上の位置または場所と考えることができます。座標平面またはグリッド上の 1 つのオブジェクトまたはフィーチャの位置または場所は、座標のペアで表すことができます。
それらは化学の不可欠な部分であり、物質の構造、光との相互作用、および化学世界の他の多くの側面を理解するための鍵です.
座標結合
有機化学で最も一般的な配位結合は、炭素原子と水素原子などの非金属原子の間の単結合です。
原子内の結合は、1 対の電子によって形成されるため、配位結合 (または共有結合) と呼ばれます。このタイプの結合は方向性結合であり、結合を形成する電子が 2 つの異なる原子核に位置しています。
配位結合の例は、水素イオンと、水素とアンモニア分子の間の電子対との間の関係ですアンモニウム分子。
結合座標または配位結合は、電気陰性原子 (σ はパウリの排他原理) と芳香環の π 電子系との間の σ 結合相互作用として定義されます。配位結合は、アセチレンや二酸化硫黄などの化合物分子に存在します。
配位結合または配位結合の性質
イオン性化合物よりも沸点と融点が低い.
電子が共有するとき、特定の方向に共有するため、それらは方向性のある結合です。
配位結合はイオン結合よりも弱い.
これらの化合物のいくつかは、異性を持っていると説明できます.
座標結合図の例
<オール>アンモニウム イオン:アンモニアでは、窒素原子がその電子対を H+ の空軌道に与えます。したがって、窒素がドナーであり、H+ がアクセプターです。 AとBの間に配位結合が形成されます。
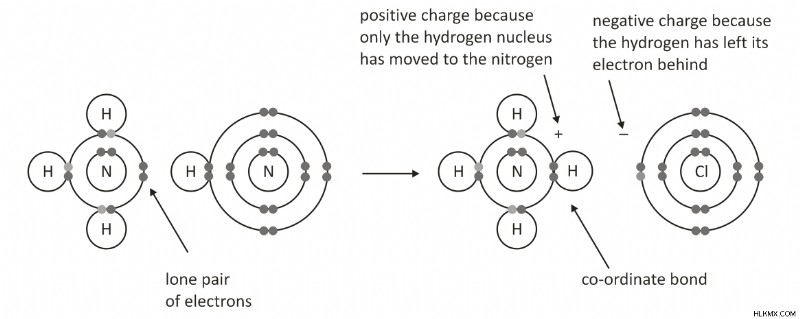
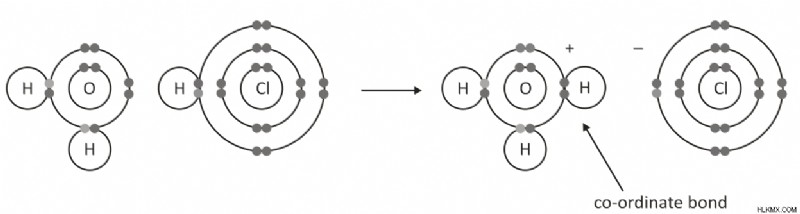
ヒドロニウム イオン:ヒドロニウム イオンは、分子式 H3O+ の化合物です。室温では無色の気体ですが、多くの場合、塩 (酸 [H+] 陽イオン) の水酸化物、OH-、水酸化物陰イオン -OH としても知られています。ヒドロニウム イオンは水素のイオン形態であり、地球上で最も一般的な形態の元素です。化学物質が水を失うと、ヒドロニウム イオンになります。
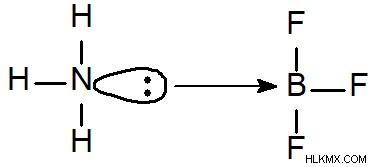
アンモニア三フッ化ホウ素:アンモニア三フッ化ホウ素は、室温および圧力で無色から白色の気体です。これは、知られている最も反応性の高い非フッ素化合物の 1 つであり、ほとんどの材料に対して腐食性があります。それは強力な温室効果ガスであり、非常に強力な酸化剤および爆発物でもあります.アンモニア三フッ化ホウ素は、主に洗浄剤および脱脂剤として、また他の化学物質の製造に使用されます。
結論
配位結合は、酸、塩基、塩の形成などの化学反応に存在します。これらの結合は、金属原子がそれを囲む四面体配位で形式電荷を持っている場合に形成されます。金属原子は配位の中心にあります。金属は通常、他の化学結合で隣接する金属と同じですが、常にそうであるとは限りません.







