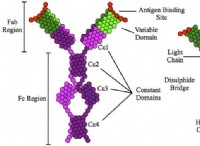
二重変位反応を理解
この反応は、二重変位反応の典型的な例です。このタイプの反応では、2つの反応物の正と陰性のイオンがパートナーを切り替えて2つの新製品を形成します。
反応
反応の一般的な形式は次のとおりです。
pbso₄(aq) + sn(clo₃)₂(aq)→? +?
製品の予測
1。イオンを識別します:
- 硫酸鉛(PbSo₄)は、Pb²⁺(鉛(II)イオン)およびSo₄²⁻(硫酸イオン)に分離します。
- 塩素酸スズ(Sn(clo₃)₂)は、Sn²(スズ(ii)イオン)およびclo₃⁻(塩素酸イオン)に解離します。
2。スイッチパートナー:
- 鉛(II)イオン(PB²⁺)は、塩素酸イオン(Clo₃⁻)と結合して鉛(II)塩素酸(PB(Clo₃)₂)を形成します。
- スズ(II)イオン(Sn²⁺)は、硫酸イオン(So₄²⁻)と結合してスズ(II)硫酸塩(Snso₄)を形成します。
バランスの取れた化学式
反応のバランスの取れた化学式は次のとおりです。
pbso₄(aq) + sn(clo₃)₂(aq)→pb(clo₃)₂(aq) +snso₄(s)
重要な注意: スズ(II)硫酸塩(SNSO₄)は水に不溶性であるため、固体として溶液から沈殿します。
したがって、新しく形成された化合物は、溶液に溶解したままである塩素酸鉛(II)(Pb(clo₃)₂)と、硫酸塩(II)(snso₄)であり、固体として沈殿します。