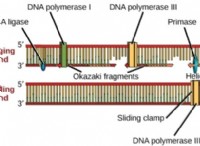
1。鉄(II)酸化物(FeO)酸を含む:
* 反応: feo +2H⁺→fe²⁺ +h₂o
* 説明: 鉄(II)酸化物は酸と反応して鉄(II)イオン(Fe²⁺)と水を形成します。
* 例: FeO + 2HCl→Fecl₂ +H₂o
2。酸性酸(III)酸化物(Fe₂O₃)を酸:
* 反応: fe₂o₃ +6h⁺→2fe³⁺ +3h₂o
* 説明: 鉄(III)酸化物は酸と反応して鉄(III)イオン(Fe³⁺)と水を形成します。
* 例: fe₂o₃ +6hno₃→2fe(no₃)₃ +3h₂o
3。鉄(II、III)酸化物(Fe₃O₄)を酸:
* 反応: fe₃o₄ +8h⁺→2fe³⁺ +fe²⁺ +4h₂o
* 説明: 鉄(II、III)は、マグネタイトとも呼ばれる酸化物とも反応して、鉄(II)と鉄(III)イオンの両方を水とともに形成します。
* 例: Fe₃O₄ + 8HCl→2FECL₃ +fecl₂ +4H₂o
重要なメモ:
* 酸の強度: 反応の反応速度と程度は、使用される酸の強度に依存します。塩酸(HCl)や硝酸(HNO₃)のような強い酸は、より容易かつ完全に反応します。
* 塩の形成: 鉄酸化物と酸の間の反応は、一般に鉄塩を形成します。形成された特定の塩は、使用される酸に依存します(例:hcl、fe(no₃)hno₃)。
* 酸化状態: 酸化鉄中の鉄の酸化状態は、得られた塩の鉄の酸化状態を決定します。
* 熱生成: 反応はしばしば発熱性であり、熱を放出します。
要約:
酸化鉄と酸の反応は、鉄イオンと水の形成をもたらします。酸化鉄の特定のタイプと使用される酸は、正確な生成物と反応条件を決定します。