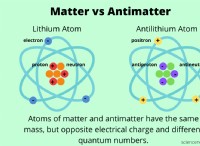
* イオン化合物: これらは、反対に帯電したイオン(陽イオンと陰イオン)間の強い静電相互作用によってまとめられています。それらは高い融点を持ち、イオン間の電子の不均一な分布により、一般に非常に極性です。
* 有機溶媒: これらは通常、炭素水素結合の存在のために非極性またはわずかに極性です。それらは、より弱いファンデルワールスの力によって一緒に保持されます。
なぜ彼らが混ざっていないのか:
* "like like dislols like": この原則によると、同様の極性を持つ物質は互いに溶解する傾向があると述べています。イオン化合物は非常に極性であり、有機溶媒は一般に非極性であるため、相互作用と溶解が困難です。
* エネルギーに関する考慮事項: イオン化合物が溶媒に溶解するためには、イオン結合を破壊するために必要なエネルギーは、イオンと溶媒分子間の新しい相互作用の形成によって放出されるエネルギーによって補償されなければなりません。
*有機溶媒では、これらの新しい相互作用(イオン双極子相互作用)は、固体のイオン結合よりも弱い。
*これは、溶媒和中に放出されるエネルギーが強力なイオン結合を破るには不十分であり、溶解があまり好ましくないことを意味します。
例外:
ほとんどのイオン化合物は有機溶媒に溶解しませんが、いくつかの例外があります。
* 極有機溶媒: エタノールやアセトンのような一部の有機溶媒は、酸素または窒素原子の存在により、極性の程度が高くなっています。これらは、いくつかのイオン化合物、特に電荷密度が高い小さな化合物を溶解することができます。
* イオン液: これらは、100°C未満の融点の溶融塩です。彼らは、独自の特性のためにいくつかの有機化合物を溶解することができます。
要約: イオン化合物の強い静電相互作用と有機溶媒の比較的弱い力は、溶解を好ましくない。 「同様の溶解のような」原理が適用され、極性イオン化合物は一般に非極性有機溶媒とうまく混ざりません。