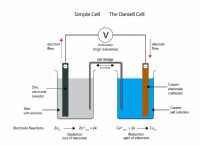
衝突特性と解離
衝突特性は、化学的アイデンティティではなく、存在する溶質粒子の *数 *に依存する溶液の特性です。 これらのプロパティは次のとおりです。
* 蒸気圧力低下: 溶液の蒸気圧は、純粋な溶媒の蒸気圧よりも低いです。
* 沸点の標高: 溶液の沸点は、純粋な溶媒の沸点よりも高くなっています。
* 凍結点うつ病: 溶液の凍結点は、純粋な溶媒の凍結点よりも低いです。
* 浸透圧力: 半膜を横切る溶媒の流れを防ぐために必要な圧力。
イオン対分子化合物
* naCl(塩化ナトリウム): 水に溶解すると、イオンに完全に解離するイオン化合物。 1モルのNaClは、2モルのイオン(1モルのNa+と1モルのCl-)を生成します。
* スクロース(C12H22O11): 水に溶解したときにイオンに解離しない分子化合物。 1モルのショ糖は1モルの分子として残っています。
衝突特性への影響
NaClはスクロースよりも多くの粒子に解離するため、衝突特性により大きな影響があります。その理由は次のとおりです。
* より多くの粒子、より大きな変化: 衝突特性の変化は、溶質粒子の数に直接比例します。溶液中のより多くの粒子は、蒸気圧、沸点、凍結点、浸透圧の大きな変化につながります。
* van't Hoff Factor: van't Hoff因子(i)は、溶質が溶液中に生成する粒子の数を説明します。 NaClの場合、i =2;スクロースの場合、i =1。
例:凍結点うつ病
凍結点うつ病を考えてみましょう:
* NaClの1モルラル溶液は、NaClが粒子の数の2倍を生成するため、スクロースの1モルラル溶液の2倍の2倍の凍結点うつ病を患っています。
要約
NaClは、そのイオン性と完全な解離により、スクロースよりも溶液中の粒子をより多く生成します。この高い粒子濃度は、衝突特性のより大きな変化につながります。