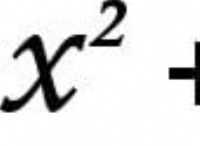1。 KCl:のモルを計算します
* KClのモル質量=39.10 g/mol(k) + 35.45 g/mol(cl)=74.55 g/mol
* kcl =(40.0 g) /(74.55 g / mol)=0.536 molのモル
2。水のほくろを計算します:
*水のモル質量(H₂O)=18.02 g/mol
*水のモル=(225 g) /(18.02 g / mol)=12.49 mol
3。溶液中の総モルを計算します:
*総モル=水のkcl +モルのモル=0.536 mol + 12.49 mol =13.03 mol
4。 KCl:のモル画分を計算します
* KCl(X_KCL)=(KCLのモル) /(総モル)=0.536 mol / 13.03 mol =0.0411のモル画分
したがって、溶液中のKclのモル画分は約0.0411です。