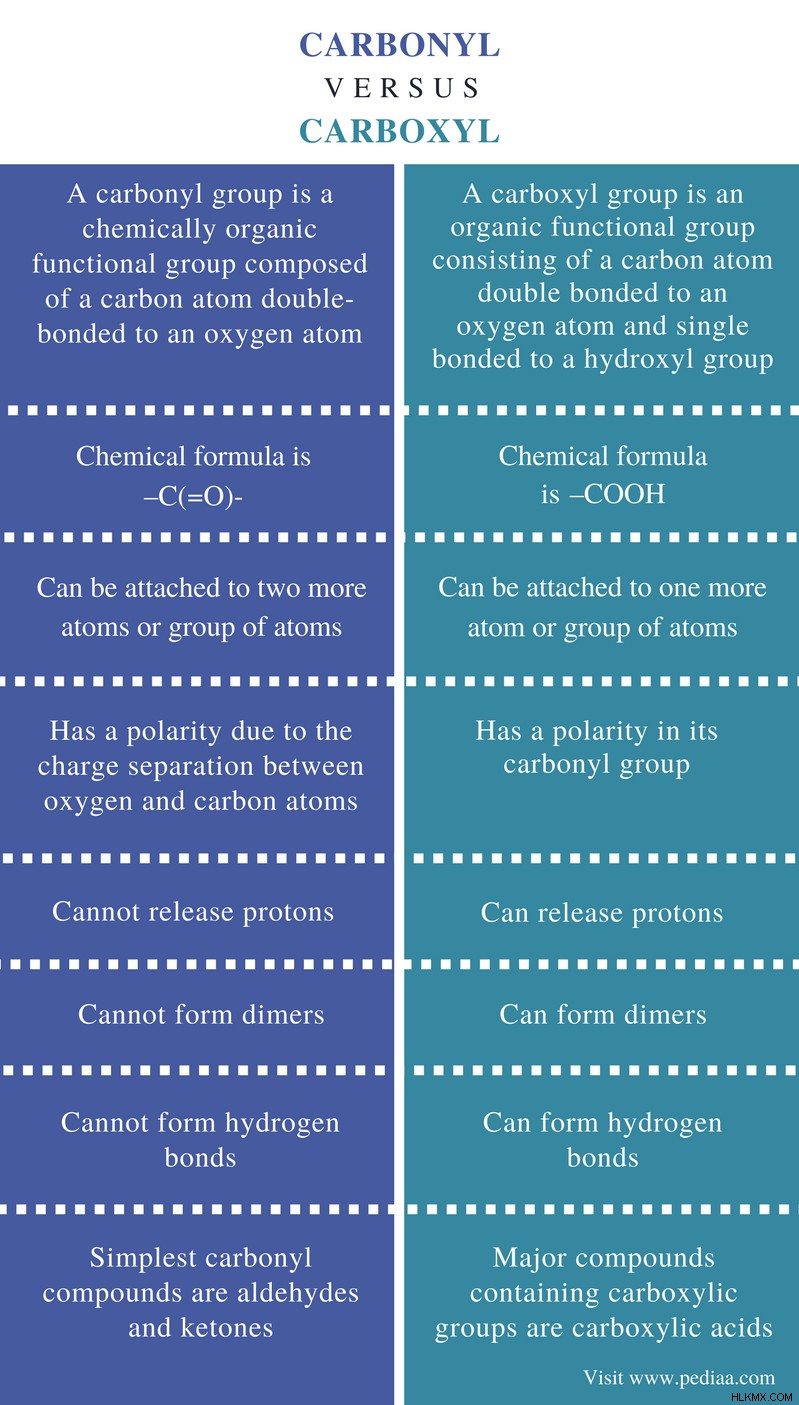
主な違い - カルボニルとカルボキシル
有機化学では、官能基は、分子内の特徴的な化学反応を担う分子内の化学基です。有機化合物にはいくつかの重要な官能基があります。カルボニル基とカルボキシル基は、そのような2つの官能基です。カルボニル基は、酸素原子に二重結合した炭素原子で構成されています。アルデヒドおよびケトンは、化合物を含むカルボニル基の例です。カルボキシル基は、二重結合を介して酸素原子に結合し、単結合を介してヒドロキシル基 (-OH) と結合した炭素原子で構成されます。カルボニル基とカルボキシル基の主な違いは、 カルボニル基は酸素原子に二重結合した炭素原子で構成されるのに対し、カルボキシル基はカルボニル基の炭素原子を介して互いに結合したカルボニル基とヒドロキシル基で構成されることです。 .
対象となる主な分野
1.カルボニルとは
– 定義、用語、化学構造と極性、例
2.カルボキシルとは
– 定義、カルボン酸、二量体形成
3.カルボニルとカルボキシルの類似点は何ですか
– 共通機能の概要
4.カルボニルとカルボキシルの違いは何ですか
– 主な相違点の比較
重要な用語:アルデヒド、カルボニル、カルボキシル、二重結合、官能基、ヒドロキシル基、ケトン、求核剤、酸素、極性
カルボニルとは
カルボニル基は、酸素原子に二重結合した炭素原子で構成される化学的に有機的な官能基です。カルボニル基を含む最も単純な有機化合物は、アルデヒドとケトンです。アルデヒドは、化学式-CHOを持つアルデヒド基で構成されています。この基には、水素原子に結合したカルボニル基が含まれています。ケトンでは、カルボニル基が 2 つのアルキル基に結合しています。
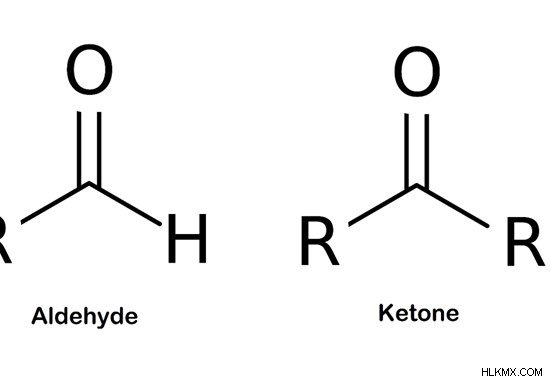
図 1:カルボニル基を含むアルデヒドとケトン
規約
- 二重結合を介して酸素原子に結合した炭素原子を含む官能基は、カルボニル官能基として知られています。
- カルボニル基を含む化合物は、カルボニル化合物として知られています。
- カルボニル基の炭素原子は、カルボニル炭素として知られています。
カルボニル炭素がスフィブリダイズします。したがって、二重結合とともに 2 つの単結合を形成できます。 C=O 二重結合は、カルボニル基にすでに存在します。したがって、カルボニル炭素はさらに 2 つの単結合を形成できます。ただし、カルボニル炭素の周囲の形状は三方平面です。
C=O 結合は、炭素と酸素の電気陰性度の値の違いにより分極しています。酸素はより電気陰性度が高く、結合電子対をそれ自体に引き付けます。次に、酸素原子は部分的に負の電荷を帯び、炭素原子は部分的に正の電荷を帯びます。このカルボニル炭素は、求核剤によって攻撃される可能性があります。カルボニル基のこの極性は、アルデヒドとケトンの反応性を引き起こします。また、カルボニル化合物の沸点が高くなります。
カルボニル化合物の例
- アルデヒド
- ケトン
- カルボン酸
- エステル
- アミド
- エノン
- ハロゲン化アシル
- 酸無水物
カルボキシルとは
カルボキシル基は、酸素原子に二重結合し、ヒドロキシル基に一重結合した炭素原子からなる有機官能基です。したがって、カルボキシル基は、カルボニル基とヒドロキシル基の組み合わせです。カルボキシル基の化学式は–COOHです。
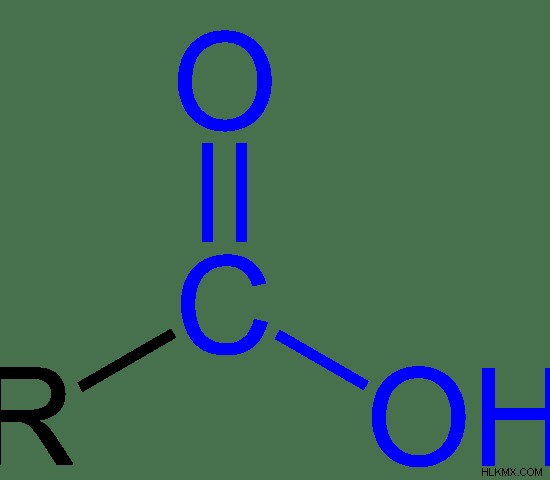
図 2:カルボキシル基の化学構造
カルボキシル基を含む化合物の主要なクラスはカルボン酸です。カルボン酸は、水素原子またはアルキル基のいずれかに結合したカルボキシル基で構成されています。ジカルボン酸は、2 つのカルボン酸を含む化合物です。
カルボキシル基はイオン化して、ヒドロキシル基からプロトン (水素原子) を放出することができます。このプロトンは遊離プロトンとして放出されるため、カルボン酸は酸です。プロトンが放出されると、ヒドロキシル基の酸素原子が負の電荷を帯びます。この負電荷は、この酸素原子の電子をカルボキシル基の他の酸素原子と共有することによって安定化されます。したがって、イオン化された形は安定しています。
カルボキシル基を含む化合物は二量体を形成できます。二量体は、結合によって結合された 2 つの構造的に類似した単量体からなるオリゴマーです。カルボキシル基の水酸基は水素結合を形成できるため、カルボキシル基間で水素結合を形成します。これにより、二量体が形成されます。
カルボニルとカルボキシルの類似点
- 両方のグループには、二重結合を介して酸素原子に結合しているカルボニル炭素原子が含まれています。
- どちらも有機化合物の官能基です。
- どちらも sp 混成カルボニル炭素原子を含んでいます。
カルボニルとカルボキシルの違い
定義
カルボニル: カルボニル基は、酸素原子に二重結合した炭素原子で構成される化学的に有機的な官能基です。
カルボキシル: カルボキシル基は、酸素原子に二重結合し、水酸基に単結合した炭素原子からなる有機官能基です。
化学式
カルボニル: カルボニル基の化学式は-C(=O)-です。
カルボキシル: カルボキシル基の化学式は–COOHです。
代役
カルボニル: カルボニル基は、さらに 2 つの原子または原子団に結合できます。
カルボキシル: カルボキシル基は、もう 1 つの原子または原子団に結合できます。
極性
カルボニル: カルボニル基は、酸素原子と炭素原子の間の電荷分離により極性を持ちます。
カルボキシル: カルボキシル基はカルボニル基に極性があります。
陽子放出
カルボニル: カルボニル基はプロトンを放出できません。
カルボキシル: カルボキシル基はプロトンを放出できます。
二量体形成
カルボニル: カルボニル基は二量体を形成できません。
カルボキシル: カルボキシル基は二量体を形成します。
水素結合
カルボニル: カルボニル基は水素結合を形成できません。
カルボキシル: カルボキシル基は水素結合を形成できます。
例
カルボニル: 最も単純なカルボニル化合物は、アルデヒドとケトンです。
カルボキシル: カルボキシル基を含む主な化合物はカルボン酸です。
結論
カルボニル基とカルボキシル基は、有機化合物の特徴的な性質を担う 2 つの有機官能基です。カルボニル基とカルボキシル基の主な違いは、カルボニル基は酸素原子に二重結合した炭素原子で構成されるのに対し、カルボキシル基はカルボニル基の炭素原子を介して互いに結合したカルボニル基とヒドロキシル基で構成されることです.
参照:
1.ヘルメンスティン、アン・マリー。 「カルボキシル基の定義と例」。
2. ThoughtCo、2017 年 9 月 3 日、こちらから入手可能。 「カルボニル基」
3. Chemistry LibreTexts、Libretexts、2017 年 9 月 10 日、こちらから入手可能。 「カルボキシル基」コロンビア百科事典、第 6 版、Encyclopedia.com、こちらから入手可能。
画像提供:
1.「アルデヒド基の骨格式」ベン・ミルズ著 – ウィキメディア・コモンズ (パブリック・ドメイン) のこのファイルのベクトル版、コモンズ・ウィキメディア経由
2. 「カルボン酸の一般構造V」Jü著–コモンズウィキメディア経由の自身の作品(パブリックドメイン)