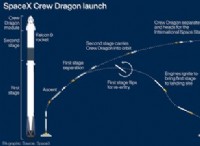
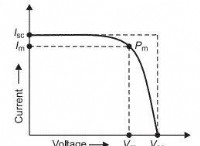
1。バランスの取れた化学式:
この反応のバランスの取れた化学式は次のとおりです。
Cu + Cl2→Cucl2
2。モル質量:
* Cu(銅):63.55 g/mol
* Cl2(塩素):70.90 g/mol
* CUCL2(塩化銅):134.45 g/mol
3。銅のモル:
* Cu =(Cuの質量) /(Cuの臼歯質量)のモル
* cu =(50 g) /(63.55 g / mol)=0.787 molのモル
4。化学量論:
バランスの取れた方程式は、銅(CU)と塩化銅(CUCL2)の間の1:1モル比を示しています。これは、0.787モルの銅が0.787モルの塩化銅を生成することを意味します。
5。 CUCL2の理論的収量:
* CUCL2 =(CUCL2のモル)の理論収量 *(CUCL2のモル質量)
* CUCL2 =(0.787 mol) *(134.45 g/mol)の理論的収量= 105.7 g
したがって、塩化銅(CUCL2)の理論的収量は105.7グラムです。
注: 101.6グラムの塩化銅が形成されたという情報は、理論的収量ではなく実際の収量です。実際の収量は、通常、実験中の反応や損失の不完全な要因により、理論的収量よりも低くなります。