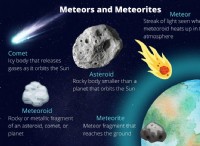
* 電子構成: アルミニウムの原子番号は13で、[ne]3s²3p¹の電子構成があります。これは、最も外側のシェルに3つの電子があることを意味します。
* 電子を失う傾向: 金属は、安定した高貴なガスの構成を実現するために電子を失う傾向があります。アルミニウムは、3つの価電子電子を失い、完全な外側のシェルを残すことでこれを達成できます(Neonのような、Nobleガスのような)。
* al³⁺の形成: アルミニウムが3つの電子を失うと、積極的に帯電したイオンが形成されます。このイオンは、電子の完全な外殻を持っているため、非常に安定しています。
* イオン結合: al³⁺イオンは、電子を獲得する傾向がある非金属とのイオン結合を容易に形成します。これにより、酸化アルミニウム(Al₂O₃)や塩化アルミニウム(Alcl₃)などの化合物が形成されます。
要約: 安定した高貴なガス構成を実現するために3つの電子を失うアルミニウムの傾向と、非金属と安定したイオン結合を形成する能力は、+3の最も一般的な酸化状態につながります。