コア コンセプト
アルコールは、有機化学者にも一般人にもなじみのある言葉です。この記事では、この言葉の有機化学の使用法に焦点を当てます。アルコールの構造、分類、命名法、およびその反応のいくつかを学びます。また、アルコールとその実際の用途のいくつかの例を探ることもできます!
他の記事で取り上げるトピック
- 有機化学における官能基
- 求核剤 – それは何ですか?
- Sn1 反応
- Sn2 反応
- E1 反応
- E2 反応
アルコール構造
アルコールは、sp 混成炭素原子に結合した水酸基 (OH 基) を持つ化合物です。つまり、OH を持つ炭素は、水素原子、アルキル基、またはその両方である 3 つの他のものに結合します。これにより、アルコールは、別の一般的なヒドロキシル含有官能基であるカルボン酸とは異なります。カルボン酸では、OH を持つ炭素が別の酸素原子に二重結合するためです。
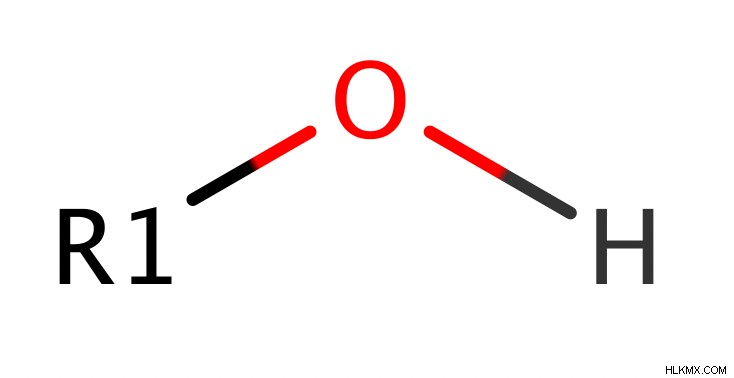
アルコールの分類 s
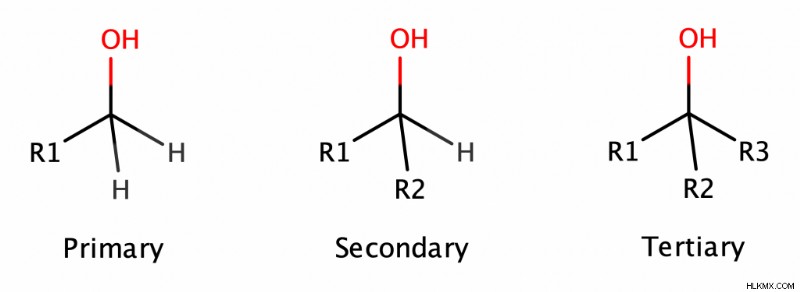
アルコールの分類は、OH基で炭素原子に結合しているアルキル基の数によって異なります。それを念頭に置いて、アルコールは第一級、第二級、または第三級アルコールに分類できます。
第一級アルコールでは、OH基を持つ炭素に1つのアルキル基が結合しています。第二級アルコールでは、結合したアルキル基の数は 2 です。そして、ご想像のとおり、その数は第三級アルコールでは 3 です。
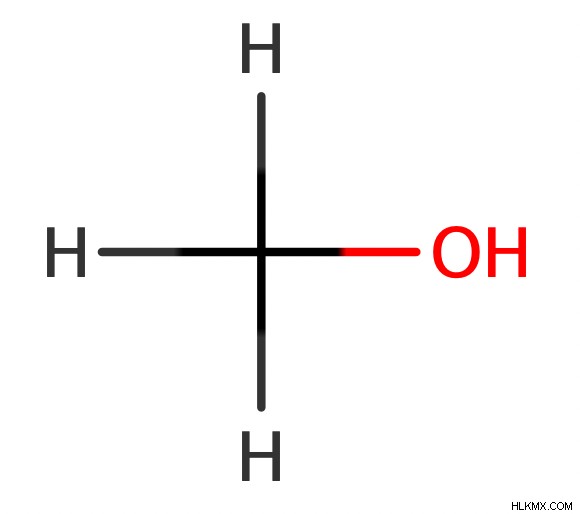
ちなみに、化学者は、OH で炭素に結合しているアルキル基がないにもかかわらず、メタノールを第一級アルコールと見なしています。
フェノール
フェノールは特別な種類のアルコールです。 「フェノール」という名前は、芳香環に結合した OH 基を持つ分子のファミリーと、そのファミリーの最も単純なメンバーである C6 の両方を指します。 H5 おー。フェノールには、通常のアルコールとは大きく異なる多くの特徴があります。たとえば、共鳴構造を形成する能力のおかげで、フェノールは通常のアルコールよりもはるかに酸性です.したがって、フェノールの反応性は通常のアルコールとは異なり、通常のアルコールが通常参加しない反応に参加することができます.このため、この記事ではフェノールにあまり焦点を当てません.

アルコールに関する簡単な事実
- 構造:水素に単結合している酸素に単結合した炭素
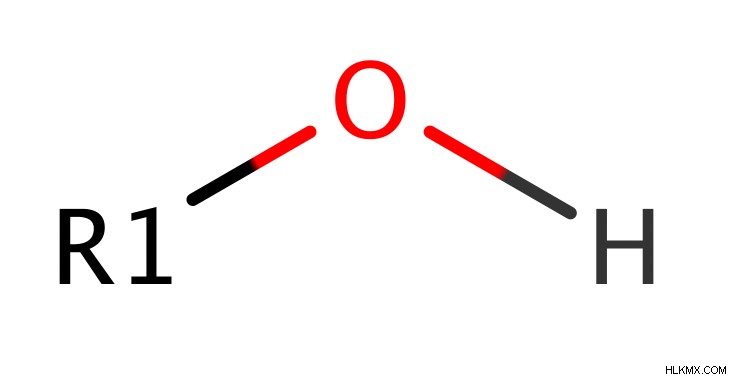
- 一般式:R-OH または ROH
- pH:中性 (約 7)。アルコールは一般に弱酸であり、その最も酸性のプロトンは OH の H です。
- pKa:一般に15から20
- メタノール (CH3 ああ):15.3
- エタノール (C2 H5 ああ):15.9
- フェノール (C6 H5 ああ):9.99
- 溶解度:極性溶媒中のアルコールの溶解度は、そのアルコールの疎水性領域 (通常は炭化水素鎖) のサイズが大きくなるにつれて減少します。たとえば、メタノールとエタノールは水に混和しますが、ノナノールは水に溶けません。
- IR 分光法:濃縮アルコール溶液は 3200 ~ 3600 cm 付近で幅広いシグナルを生成します
アルコールの命名法
IUPAC命名法を使用してアルコールに名前を付けるには、次の手順に従います:
- まず、OH 基を含む最長の鎖である親を特定します。
- 次に、OH 基と他の置換基 (存在する場合) に番号を割り当てて、分子内の位置を示します。 OH グループは、可能な限り最小の数を取得する必要があります。
- 最後に、親アルカンの接尾辞「-e」を「-ol」に変更します。
分子に複数の OH 基がある場合は、「-ol」の前に「di」や「tri」などの接頭辞を挿入します。このような場合、親アルカンの「-e」を保持してください。
アルコール部分 (より具体的には、ヒドロキシル基) が分子の単なる置換基である場合 (つまり、より優先度の高い官能基が存在する場合)、その分子の親名の前に接頭辞「ヒドロキシ-」を付けます。
アルコール反応
一般的な反応の傾向
アルコールの反応性のホットスポットは OH 基です。 OH 基全体または H だけを除去することを含む多くの反応が見られます。酸素の高い電気陰性度により、酸素に結合した C および H が求電子性になり、電子が豊富な分子と反応します。
しかし、アルコールの反応に飛び込む前に、まずアルコールを合成する方法を見てみましょう.
アルコールの調製
置換反応
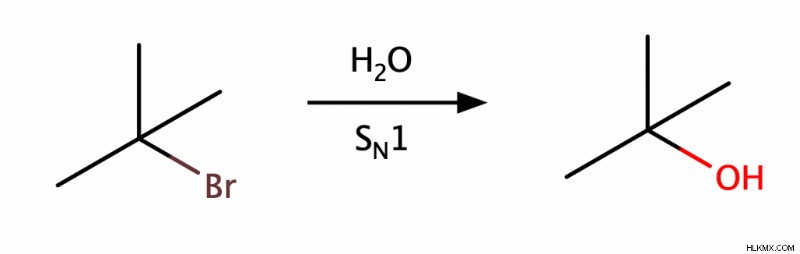
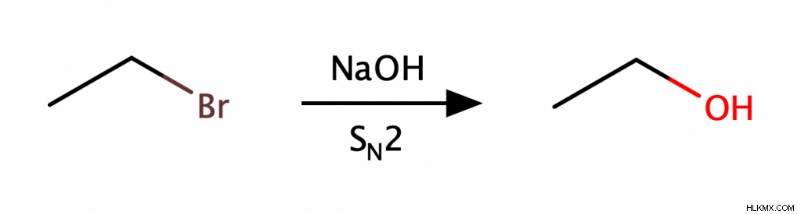
SN のいずれかを使用してアルコールを生成できます 1 または SN 2置換反応。 SN 1つの反応は通常、第三級アルコールを生成しますが、SN 2 反応は通常、第一級アルコールを生成します。
付加反応
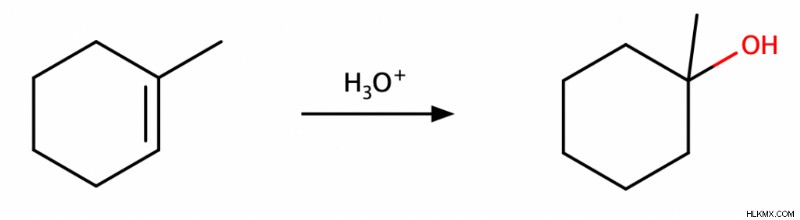
アルケンは水和してアルコールを生成することができます。これらの水和反応の詳細については、アルケンに関する記事をご覧ください。
還元反応
水素化ホウ素ナトリウム (NaBH4 ) または水素化リチウム アルミニウム (LAH)。さらに、LAH の反応性により、カルボン酸やエステルをアルコールに還元することもできます。これらの還元剤は陽子源として機能し、その陽子を反応物に与えます。


グリニャール試薬
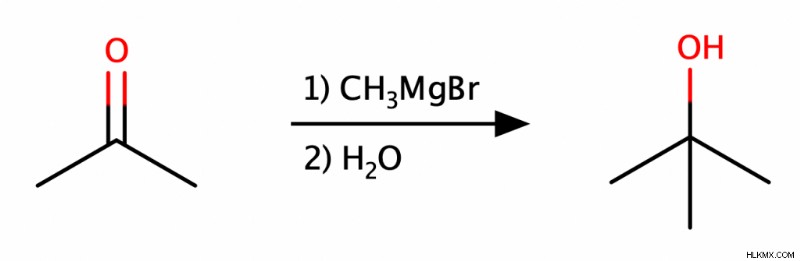
グリニャール試薬は、マグネシウムで処理されたハロゲン化アルキルです。グリニャール試薬には求核性炭素があり、さまざまな求電子剤を攻撃できるため、炭素骨格の構築に役立ちます。私たちの場合、アルデヒド、ケトン、およびエステルはすべてグリニャール試薬によって攻撃され、その後プロトン化を受けてアルコールを生成する可能性があります.
アルコールの反応
置換反応
アルコールは、ハロゲン化アルキルを形成する置換反応を受けることができます。 3級アルコールはSNしか受けない 1反応;第二級アルコールは SN を受けることができます 1回の反応ですが、速度が遅いため、一般的にSNを受けることを好みます 2反応;第一級アルコールは SN のみを受ける 2反応。
OH は悪い脱離基であるため、OH をより良い脱離基に変換することは、すべてのアルコール置換反応のメカニズムで必要なステップであることに注意することが重要です。
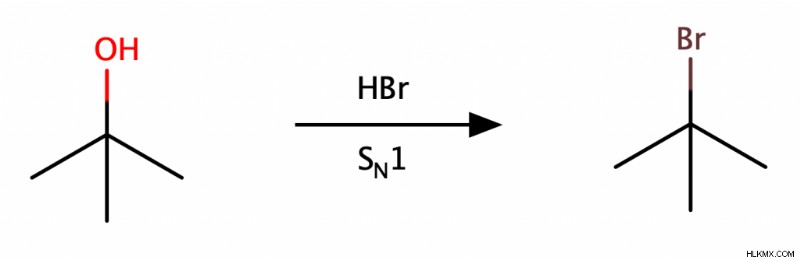
脱離/脱水反応
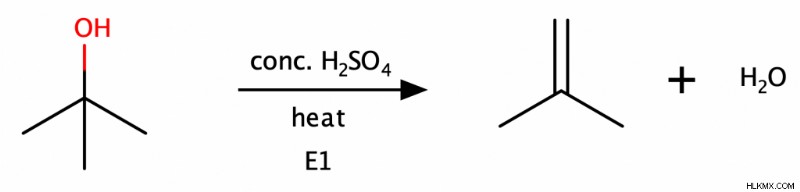
第二級および第三級アルコールは、酸性条件下で E1 反応を受けてアルケンを形成します。この反応は水分子も除去するため、化学者はこれを「脱水反応」とも呼びます。第一級アルコールも E2 メカニズムを介して脱水反応を起こすことができますが、第二級および第三級アルコールよりもはるかに遅い速度です。
酸化反応
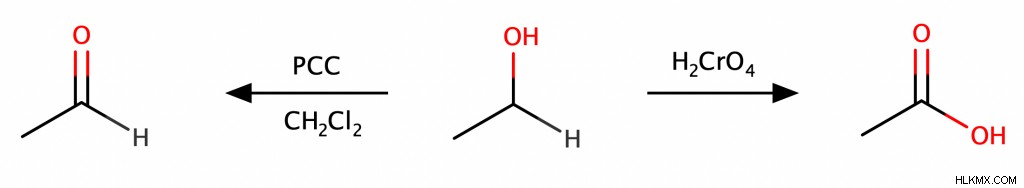
第一級アルコールは、酸化を受けてアルデヒドまたはカルボン酸を生成する可能性があります。酸化剤を慎重に選択することで、製品を制御できます。クロム酸 (H2 CrO4 ) は第一級アルコールをカルボン酸に直接酸化しますが、クロロクロム酸ピリジニウム (PCC と略される) のようなより穏やかでより選択的な酸化剤は、第一級アルコールをアルデヒドに酸化するだけです。
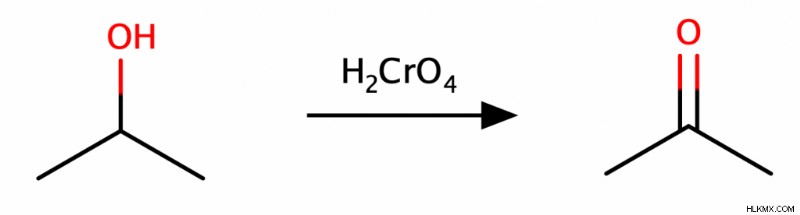
二級アルコールは酸化するとケトンしか生成せず、三級アルコールは酸化しません。 (理由を理解するには、水素原子の除去が分子の酸化状態を増加させる最善の方法であることを思い出してください。残念ながら、3級アルコールでは、OH基を持つ炭素は除去可能な水素原子に結合していません.)
エステル化
アルコールは、触媒酸と熱の存在下でカルボン酸と反応してエステルを生成します。化学者はこの反応をフィッシャーエステル化と呼んでいます。詳細については、次の記事をご覧ください:エステル官能基とエステル化
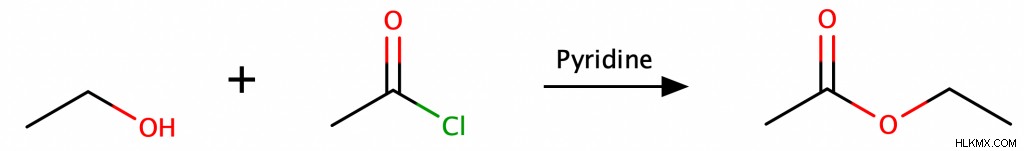
アルコールは、中和ピリジンの存在下で酸塩化物 (塩化アシルとも呼ばれます) と反応すると、エステルを生成することもあります。
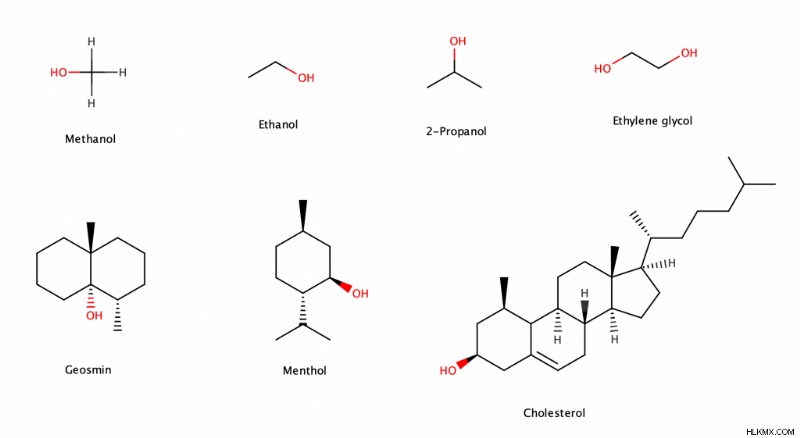
アルコールの例
- メタノール (またはメチルアルコールまたは木アルコール) (CH3 OH) は、自動車や船の燃料を作るために最も一般的に使用されています。
- エタノール (またはエチルアルコール) (C2 H5 OH) はアルコール飲料に含まれるアルコールです。飲み物の種類によってエタノール濃度が異なります。たとえば、ウイスキーにはシャンパンよりもエタノールの濃度が高く、シャンパンには標準的なビールよりもエタノールの濃度が高くなります。
- 2-プロパノール (またはイソプロピルアルコール) ((CH3 )2 CHOH) は、洗剤や手指消毒剤などの製品の洗浄と消毒に使用されます。
- エタン-1,2-ジオール (またはエチレングリコール) ((CH2 ああ)2 ) は不凍液の主成分です。
- ゲオスミン (C12 H22 O) は二環式アルコールで、雨に独特の土のようなにおいを与えます。
- メンソール (C10 H20 O) は、歯磨き粉、マウスウォッシュ、チューインガムなどの製品が与えるミントのようなさわやかな感覚の原因です。
- コレステロール (C27 H46 O) は、体が細胞膜、いくつかのホルモン、胆汁酸、ビタミン D を作るのを助ける脂質の一種です。

参考文献
- アルドール縮合反応
- エーテル官能基
- チオール官能基
- 壮大なマグネシウム







