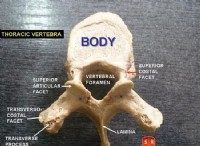
その理由は次のとおりです。
* 原子半径: 原子半径とは、原子の核と最も外側の電子シェル間の距離です。フッ素は、炭素よりも小さな原子半径を持っています。
* 電気陰性度: フッ素は最も電気陰性の要素であり、電子に強い魅力を持っていることを意味します。この強い引力は、電子を核の近くに引っ張り、原子半径を小さくします。
* 核電荷: フッ素は、炭素よりも高い核電荷(核でより多くの陽子)を持っています。このより強い引力は、電子を核の近くに引っ張り、原子半径をさらに減らします。
要約すると、炭素と比較したフッ素の原子半径が小さいのは、電気陰性度が高く、核電荷が強いためです。