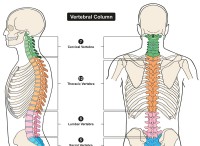
その理由は次のとおりです。
* 電子構成: 遷移金属には、部分的に満たされたD軌道があります。より安定した電子構成を実現するために、SおよびD軌道から電子を失う傾向があります。この電子の損失は、陽性に帯電したイオン(陽イオン)の形成をもたらします。
* 電気促進性: 遷移金属は一般に電気依存症です。つまり、電子を失い、陽性イオンを形成する傾向があります。
* 酸化状態: 遷移金属は可変酸化状態を示します。これは、異なる数の電子を失う能力の直接的な結果です。
例:
*鉄(fe)はfe²⁺およびfe³⁺カチオンを形成します。
*銅(cu)はcu⁺およびcu²⁺カチオンを形成します。
*亜鉛(Zn)はZn²⁺カチオンを形成します。
例外:
*一部の遷移金属は、特定の条件で陰イオンを形成できます。たとえば、マンガン(MN)はMnO₄⁻(過anganate)アニオンを形成できます。
ただし、遷移金属による陰イオンの形成は、陽イオンの形成よりも一般的ではありません。