精力的な好感度
反応物の濃度は常に重要であり、特に律速段階の反応物は重要です。反応は、エネルギー的に有利な場合に進行します。平衡反応では、生成物に対する反応物の濃度が △ を変化させます 反応のG;生成物に対する反応物の比率が不均衡で、生成物あたりの反応物が多い場合、△ G はエントロピーによって低下します。
化学者はこれらの要因が反応を促進すると言うことに注意することは重要ですが、エネルギー的好感度は速度決定ステップとは何の関係もありません . △ G は反応速度について何も教えてくれません。同時に、レート制限ステップについては何も教えてくれません。
レート決定ステップとは?
反応の中で最も時間がかかる工程です。これは反応メカニズムの中で最も遅い部分であり、全体的な反応がどれだけ速く起こるかを決定します。
律速段階と活性化エネルギーの関係
レート決定ステップをどのように決定しますか?すべての反応が発生するためには、反応物が活性化エネルギーに打ち勝たなければなりません。この活性化エネルギーは、生成物または重要な中間体を形成するために必要な結合を切断するために必要なエネルギー量に相当します。 律速段階は、活性化エネルギーが最も高い反応です
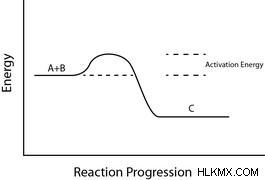
活性化エネルギーに影響を与える要因はごくわずかです。上記のように、結合を切断するために必要なエネルギーは、活性化エネルギーの主要な要素です。さらに、安定した結合を壊して不安定な結合を形成すると、不安定な中間体が形成されます。これらの不安定な中間体の形成はエネルギー的に好ましくなく、通常は最も活性化エネルギーが高くなります.
ただし、立体障害も反応の活性化エネルギーに影響を与える可能性があります。立体障害とは、分子内の原子が互いに反発したり、他の分子からの原子が反発したりするという考えです。本質的に、電気陰性度の低い分子への他の結合の存在は、反結合性軌道を部分的にブロックします。衝突理論でラベル付けされているように、反結合軌道が部分的にブロックされている場合、反応は立体障害の存在下でより遅く進行します.
いくつかの活性化エネルギー
有機化学では、多くの反応の曲がった矢印のメカニズムを学びました。これらの曲がった矢印は、反応が起こるために分子が形成する中間体を示しています。有機化学で見たように、ほとんどの反応にはディールス・アルダー反応のような協調矢印はありません。代わりに、ほとんどの反応は、生成物に到達する前に 1 つまたは複数の中間体を形成します。これらの各中間体の形成には、それぞれ独自の活性化エネルギーがあります。
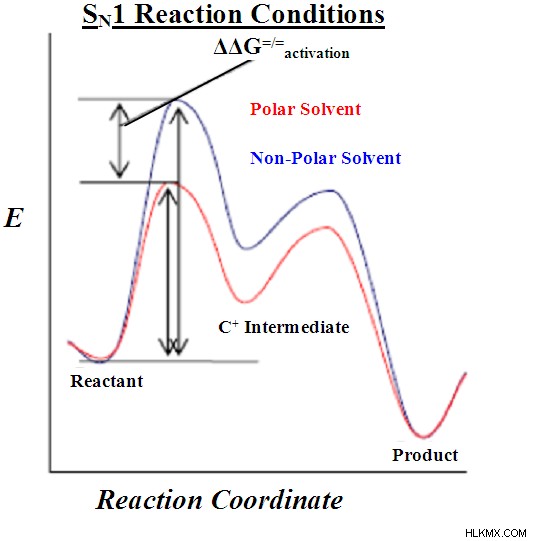
上はSN1反応のエネルギープロファイルです。ご覧のとおり、カルボカチオン中間体の形成には、生成物を形成する反応とは別に、独自の活性化エネルギーがあります。偶然にも、反応のこのステップは律速ステップでもあります。これは、エネルギー プロファイルで最も高い活性化エネルギーがあるためです。
エネルギー プロファイルのレート決定ステップ
エネルギープロファイルの律速段階は、最高の活性化エネルギーを持つものです。エネルギープロファイルは、すべての中間体と生成物の形成のための活性化エネルギーを与えることにより、このステップをもたらします。一般的に言えば、最も不安定な中間体を形成するステップが反応速度を決定します。
レート決定ステップの例
カルボカチオンやエノラートなどの中間体の形成 (LDA を使用しない場合) は、非常にエネルギー的に好ましくなく、通常は非常に特殊な条件下でのみ進行します。一般に、生成物として優れた求核試薬または求電子試薬を生成する半反応または反応機構の一部が律速段階です。
半反応の速度決定ステップ
半反応では、多くの場合、コースでは半反応を「遅い」と表現します。このゆっくりした反応が律速段階です。別のオプションは、湾曲した矢印のメカニズムを分解することです。不安定な中間体が生成される場所を特定します。この反応は律速段階である可能性があります。
レート決定ステップと反応レート
速度決定ステップが特定されると、そのステップに関与する反応物は、速度法則式の分子になります。化学者は、反応の速度法則方程式を実験的に計算して決定することしかできません。反応物の順序の識別子はありません。速度法則式を知るには、さまざまな濃度で 3 つの反応を実行し、それらの半減期を測定します。
さらに、速度定数は実験条件に固有ですことに注意することが重要です。 、温度など。これらの環境要因の変化は、反応の速度定数に影響を与えます。