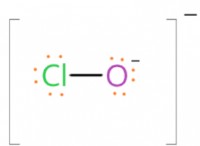1。価電子と結合:
* 最も外側のシェル(価電子)の電子は化学結合に関与しています。 それらは他の原子と結合を形成して、安定した電子構成を実現します。
* 形成される結合のタイプは、原子価電子の数と関連する原子の電気陰性度に依存します。 たとえば、単一の結合には1つの共有電子ペア、二重結合には2つの共有電子ペアなどが含まれます。
2。電子反発およびVSEPR理論:
* 価電子シェル電子ペア反発(VSEPR)理論は、中央原子の周りの電子ペア(結合と非結合の両方)が反発を最小限に抑えるために自分自身を整えると述べています。 この配置は、特定の分子形状につながります。
* 電子の孤独なペア(非結合ペア)は、結合ペアよりも強い反発を発揮します。 これは、孤立したペアが中心原子の周りに局在しているのに対し、結合ペアは2つの原子間で共有されるためです。
3。ハイブリダイゼーション:
* 場合によっては、原子軌道がハイブリダイズして、結合に適した新しいハイブリッド軌道を形成することができます。
* ハイブリッド軌道の数と配置が分子の形状を決定します。 たとえば、SP3のハイブリダイゼーションは四面体の形状につながり、SP2のハイブリダイゼーションは三角平面形状などにつながります。
4。分子形状と結合角:
* 分子内の原子の配置は、その分子形状と呼ばれます。
* 分子内の結合間の角度は結合角と呼ばれます。
* 分子形状と結合角の両方が、中央原子の周りの電子ペアの影響を受けます。
例:
* 水(H2O): 酸素には、2つの孤立ペアと2つの結合ペアの電子があります。 VSEPR理論は、約104.5°の結合角で曲がった形状を予測します。
* メタン(CH4): 炭素には、電子の4つの結合ペアがあります。 VSEPR理論は、109.5°の結合角を持つ四面体形状を予測します。
* 二酸化炭素(CO2): 炭素には、酸素原子を持つ2つの二重結合があります。 VSEPR理論は、180°の結合角を持つ線形形状を予測します。
結論として、原子の周りの電子の配置は分子の形状を決定します。 VSEPR理論とハイブリダイゼーションの原理を理解することにより、さまざまな分子の形状を予測および説明できます。