1。定義の理解:
* 強酸: イオン化する酸(陽子、H+を寄付します)を完全に溶液にします。これは、実質的にすべての酸分子がイオンに分解されることを意味します。
* 弱酸: 溶液中に部分的にのみイオン化する酸。酸分子のごく一部のみが陽子を寄付します。
2。キーインジケーター:
* イオン化定数(ka): この値は、弱酸のイオン化の程度を定量化します。
* 強酸は非常に大きなKa値を持っています(通常> 1)。 これは、高度なイオン化を示しています。
* 弱酸はKa値が小さい(通常<1)。 これは、低いイオン化を示しています。
* ph: 強酸は非常に低いpH(酸性度が高いことを示しています)を持ち、弱酸はpHが高くなります。
* 一般的な酸リスト: あなたが暗記すべきいくつかの強酸があります。これらは常に強いです:
* hcl(塩酸)
* hbr(水臭素酸)
* hi(水力酸)
* hno3(硝酸)
* H2SO4(硫酸)
* hclo4(過塩素酸)
3。実用的な考慮事項:
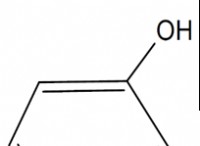
* 化学式: 分子内に特定のグループが存在すると、ヒントを与えることができます。たとえば、カルボン酸(R-COOH)は通常、弱酸です。
* 実験: 酸溶液の導電率をテストできます。強酸は、イオンの濃度が高いため、弱酸よりもはるかに優れた電気を行います。
例:
* 塩酸(HCl): これは強酸です。それは溶液中に完全にイオン化するため、ほぼすべてのHCl分子がH+およびCl-イオンに解離することを意味します。そのKA値は非常に大きいです。
* 酢酸(CH3COOH): これは弱酸です。酢酸分子のごく一部のみが溶液中に陽子(H+)を寄付します。そのka値は小さい(約1.8 x 10^-5)。
重要な注意: 「強い」および「弱い」という用語は、酸性度ではなく、イオン化の程度を指します。強酸は高濃度であり、したがって非常に腐食性がありますが、弱酸が十分に濃縮されると腐食性もあります。