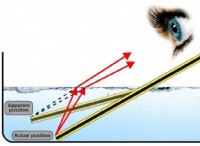
Hclの理解
* 強酸: HClは強酸であり、水で完全にイオン化することを意味します。これは、HClのすべての分子が溶解すると水素イオン(H+)を寄付することを意味します。
* イオン化: HCl(aq)→H +(aq) + cl-(aq)
pHの計算
1。水素イオン濃度: HClは完全にイオン化するため、H+イオンの濃度はHClの初期濃度に等しくなります。したがって、[H+] =0.1 M
2。 pH式: ph =-log [h+]
3。計算: ph =-log(0.1)=1
pohの計算
1。 pHとPOHの関係: ph + poh =14
2。計算: poh =14 -ph =14-1 =13
要約
* 0.1 m Hcl =1 のpH
* 0.1 m Hcl =13 のpoh