* 電気陰性度: これは、化学結合で電子を自分自身に引き付ける原子の傾向の尺度です。
* エレクトロポジティブ要素: これらは、電気陰性度が低い要素です。彼らは電子を簡単に失う傾向があります。 例には、ナトリウム(NA)やカリウム(K)などの金属が含まれます。
* 電解要素: これらは、電気陰性度の高い要素です。彼らは電子を強く引き付けます。例には、酸素(O)や塩素(CL)などの非金属が含まれます。
それがどのように機能するか:
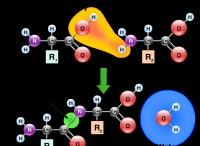
1。電子伝達: 電気依存症の要素が電気陰性要素と結合すると、電気陰性要素は電子を電気陽性要素から引っ張ります。これにより、電子が完全に伝達されます。
2。イオンの形成: 電気陽性要素は電子を失い、正に帯電したイオン(陽イオン)になります。電気陰性要素は電子を獲得し、負に帯電したイオン(アニオン)になります。
3。静電引力: その後、反対に帯電したイオンは、静電力を通して互いに引き付けられ、イオン結合を形成します。
イオン結合の重要な特徴:
* 電気陰性度の高い差: 2つの原子間の電気陰性度の違いが大きいほど、結合がイオン性になる可能性が高くなります。
* 電子の完全な伝達: これにより、完全な電荷でイオンが形成されます。
* 強い静電引力: これにより、イオン化合物は通常、融点と沸点が高くなります。これは、それらをまとめる強力な静電力を破るために多くのエネルギーが必要であるためです。
例:
塩化ナトリウム(NaCl)の形成を検討してください。
*ナトリウム(Na)は電気依存症であるため、1つの電子を失い、Na⁺を形成します。
*塩素(Cl)は電気陰性であり、1つの電子を獲得してCl⁻を形成することを意味します。
*反対に帯電したイオン(Na⁺とcl⁻)は、静電力を通して互いに引き付けられ、イオン結合を形成します。
要約: 電気陽性と電気陰性の原子間の電気陰性度の大きな違いは、電子の完全な伝達につながり、静電力によって互いに引き付けられるイオンを生成し、イオン結合をもたらします。