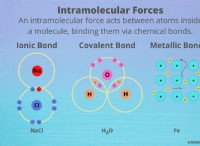
イオン結合:
* 層: 金属と非金属の間で発生し、1つの原子(金属)が電子を失い、正に帯電した陽イオンになり、もう1つの原子(非金属)が電子をゲートして負に帯電した陰イオンになります。これらの反対の電荷は互いに引き付けられ、イオン結合が形成されます。
* 強さ: 比較的強力で、融点と沸点が高くなります。
* プロパティ: 硬い結晶構造、水に溶解すると電気の良好な導体を形成します。
共有結合:
* 層: 安定した電子構成を実現するために電子を共有する2つの非金属の間で発生します。
* 強さ: 共有結合の種類(シングル、ダブル、トリプル)によって異なる場合がありますが、一般にファンデルワールスの力よりも強いです。
* プロパティ: さまざまな融点と沸点を備えたガス、液体、または固体を形成することができます。
van der waals forces:
* 層: 原子と分子の周りの電子分布の一時的な変動から生じる弱い引力。
* 強さ: イオンまたは共有結合に比べて非常に弱い。
* プロパティ: 主に融点や沸点などの物質の物理的特性の原因は、分子間相互作用にも影響します。
重要な違い:
* 電子移動対共有: イオン結合には電子の完全な伝達が含まれますが、共有結合には電子の共有が含まれます。ファンデルワールスの力は、電子雲の変動によって引き起こされる一時的な相互作用です。
* 強さ: イオン結合は最も強いものであり、その後に共有結合が続き、次にファンデルワールス力が続きます。
* 自然: イオン結合は静電相互作用であり、共有結合は共有電子に基づいており、ファンデルワールスの力は一時的な変動です。
結論:
3つはすべて化学的相互作用のタイプですが、形成、強度、特性が根本的に異なります。意味のある方法で「同様」と見なすことはできません。