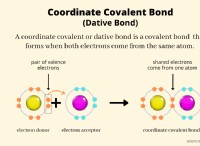
1。酸と塩基の強度:
* 強酸/強いベース: 強酸(HClのような)を強力なベース(NAOHのような)と混合すると、酸と塩基が等量で存在する場合、溶液のpHは中性(約7)になります。これは、強酸とベースが完全に解離し、水と塩を形成するためです。
* 弱酸/弱い塩基: 酸と塩基の両方が弱い場合、溶液のpHは酸と塩基の相対強度に依存します。 2つのうち強いほどpHが決定されます。
* 強酸/弱い塩基: 強酸と弱い塩基を混合すると、酸性溶液が生じます。
* 弱酸/強いベース: 弱酸を強いベースと混合すると、基本的な解がもたらされます。
2。酸と塩基の濃度:
*酸または塩基の濃度が高いほど、溶液のpHへの影響が大きくなります。たとえば、HClの1M溶液は、HClの0.1M溶液よりも酸性になります。
3。酸とベースのモル比:
*酸のモルの比と塩基のモルの比は、得られる溶液が酸性、塩基性、または中性であるかどうかを決定します。
*酸と塩基のモルが等しい場合、溶液は中性になります。
*より多くのモル酸がある場合、溶液は酸性になります。
*より多くのモルのベースがある場合、ソリューションは基本になります。
4。温度:
*温度は溶液のpHに影響を与える可能性があります。 たとえば、温度が上昇すると純水のpHが減少します(より酸性になります)。
5。平衡定数:
*酸および塩基解離反応(KAおよびKB)の平衡定数は、溶液のpHの決定に役割を果たします。強い酸と塩基は、それぞれKaとKbの値が大きくなります。
6。希釈:
*溶液を希釈すると、pHが変わります。 酸性溶液に水を追加すると酸性が低下すると、基本的なソリューションに水を追加すると、基本が少なくなります。
7。一般的なイオン効果:
*溶液が酸とその共役塩基(または塩基とその共役酸)の両方を含む場合、共通のイオン効果はpHに影響します。共通イオンの存在は、酸または塩基の解離を抑制し、PKAまたはPKBに近いpHにつながります。
酸と塩基の混合物の正確なpHを計算することは複雑であり、平衡定数やその他の熱力学的原理を使用する必要があることに注意することが重要です。ただし、上記の要因を理解することは、一般的なpH傾向を予測するための良い基盤を提供します。