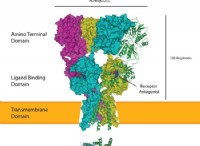
1。グループ(列)番号:
* グループ1(アルカリ金属): これらの金属は最も反応性が高く、グループを下ると反応性が向上します。これは、簡単に失われ、+1電荷につながる単一の原子価電子によるものです。
* グループ2(アルカリアース金属): これらの金属も非常に反応性がありますが、2つの原子価電子を持っているため、アルカリ金属よりもそうではありません。それらは+2イオンを形成します。
* 遷移金属: これらの金属は、特定の電子構成やその他の要因に応じて、さまざまな反応性を示します。一般に、それらの反応性は、期間全体で左から右に低下します。
* グループ13-16: これらのグループの金属の反応性は、グループ1および2と比較して大幅に減少します。
2。期間(行)番号:
* グループを下る: 反応性が増加します。これは、最も外側の電子が核から遠く離れており、より弱い引力を経験し、除去しやすいためです。
* 期間を超えて移動: 反応性は一般に低下します。原子数が期間にわたって増加すると、核内の陽子の数が増加し、電子をより強く引き付け、それらを除去するのが難しくなります。
3。イオン化エネルギー:
* イオン化エネルギー 原子から電子を除去するために必要なエネルギーです。イオン化エネルギーが低いほど、電子を除去しやすくなり、反応性が高くなります。
4。電気陰性度:
* 電気陰性 原子が電子を引き付ける傾向です。一般に、金属は電気陰性度が低いため、電子を失い、正に帯電したイオンになる可能性が高くなります。
概要:
* 周期表の左側の金属(グループ1および2)は、一般に右側の金属よりも反応的です。
* グループを下ると反応性が向上します。
* 期間を移動すると反応性が低下します。
例:
* リチウム(li) 、グループ1の最初の要素は、最も反応性の高いアルカリ金属です。水、空気、さらにはハロゲンと激しく反応します。
* 金(au) 、遷移金属に位置するものは、非常に非重要な金属であるため、宝石やその他の用途での使用が使用されています。
* ナトリウム(Na) 、グループ1では、マグネシウム(mg)よりも反応的です グループ2で。
これらの傾向を理解することで、金属の反応性と、さまざまな用途での潜在的な用途を予測することができます。